欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是。
(2)下列说法正确的是。
| a.酸性:H2CO3>H2SiO3 |
b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 |
d.离子半径:O2-<Al3+ |
(3)该矿石的组成是,滤渣和NaOH溶液反应的离子方程式是。
(4)该矿石和1 molL-1HNO3反应的离子方程式。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 molL-1 HNO3的体积为L。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g)ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g)ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不
变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mgL-1) |
成分 |
含量/(mgL-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42- |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是。
②在阴极附近产生少量白色沉淀,其成分有和CaCO3,生成CaCO3的离子方程式是。
③淡水的出口为(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是,吸收塔中发生反应的离
子方程式是。用平衡移动原理解释通空气的目的是。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为L(忽略Cl2溶解)。
常温下,将0.1000 molL-1 NaOH溶液滴入20.00 mL 0.1000 molL-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是(填序号)。
a.2c(Na+)= c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V20.00 mL(填“>”、“<”或“=”)。
Ⅰ.对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。其结构简式如图所示: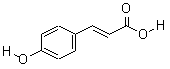
(1)该有机物具有的官能团名称是(写出其中的两种)
(2)该有机物能发生的反应类型是(填写代号)。
| A.酯化反应 | B.消去反应 | C.加成反应 | D.水解反应 |
Ⅱ.芳香族化合物C10H10O2有如下的转化关系: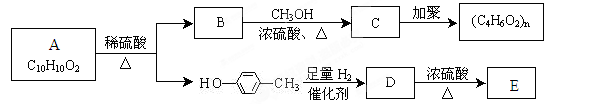
已知E能使Br2/CCl4溶液褪色。请回答下列问题:
(3)请写出A的结构简式:。
(4)若有机物F与C互为同分异构体,则与有机物B互为同系物的F的同分异构体有
种。
(5)请写出B→C反应的化学反应方程式。