四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
| 元素 |
A |
B |
C |
D |
| 性质、结构信息 |
价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层有1对成对的p电子。 |
第三周期中电离能最小的元素。 |
原子最外电子层上s电子数等于p电子数。 其一种单质为自然界中硬度最大的非金属单质。 |
(1)写出元素B基态原子的电子排布图 。
(2)元素A形成的气态氢化物的空间构型为 。(3)元素B和C形成的化合物的电子式是 。
(4)元素D形成的化合物D2H2属于 (填“极性”或“非极性”)分子。
(5)A、C、D三种元素的电负性由小到大的顺序是_________(用元素符号表示)。
【化学——化学与技术】石膏(CaSO4·2H2O)是某些化工生产中的副产物,其可用作医学材料和建筑材料,也可将石膏转化为硫酸钾肥料和氯化钙水合物储热材料,以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。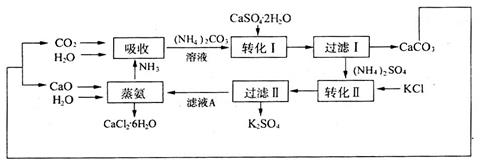
(1)本工艺中所用的原料除CaSO4·2H2O、KCl、H2O外,还需要________________;
(2)“吸收”工艺过程中,分别将CO2、NH3通入水中,反应生成(NH4)2CO3,实际操作中为生成较多的(NH4)2CO3,应先在水中通___________,理由是___________________;
(3)写出向石膏悬浊液中加入(NH4)2CO3溶液后发生反应的离子方程式:_____________;
(4)过滤I所得滤液中的溶质主要是(NH4)2SO4,也可能含有未完全反应的(NH4)2CO3,检验(NH4)2CO3是否存在的方法是____________________________________;
(5)滤液A中主要的溶质为__________________________________________________;
(6)上述工艺流程中是如何体现“绿色化学”思想的?____________________________。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在25℃测得):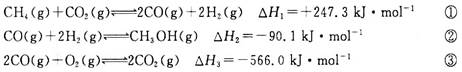
(1)25℃时,用CH4和O2直接制备甲醇蒸气的热化学方程式为________________;
(2)某温度下,向容积为4 L的恒容密闭容器中通入6 molCO2和6 mol CH4,发生反应①,5 min后反应在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5 min内的平均反应速率v(CO)=________mol·L-1·min-1;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数________(填“增大”“不变”或“减小”);
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,25℃时,其反应的热化学方程式为:
科研人员对该反应进行了研究,部分研究结果如下图所示: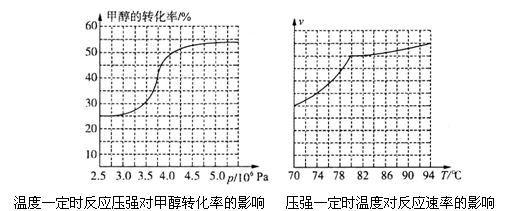
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸甲酯应选择的是_______(填下列序号字母)
a.3.5×106Pab.4.0×l06Pac.5.0×106Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是______________
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示: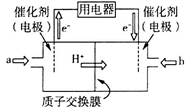
①通入气体a的电极是电池的_____(填“正”或“负”)极,其电极反应式为__________;
②25℃时,用此电池以石墨作电极电解0.5 L饱和食盐水(足量),若两极生成的气体共1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液体积的变化)。
【化学、选修3--物质结构和性质】
I.如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。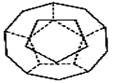
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:
C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。
请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_______,1 mol该分子中含有π键的数目为______。该分子中碳原子的杂化轨道类型是_______,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
【化学、选修2--化学与技术】TiO2用途非常广泛,工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下:
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式,酸浸时为了提高浸出率,可以采取的措施有(任写二种)。
(2)钛铁精矿酸浸后冷却、结晶得到的副产物A为,结晶析出A时,为保持较高的酸度不能加水,其原因可能为。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是。
(4)上述工艺流程中体现绿色化学理念的是。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式:,。