【化学、选修2--化学与技术】TiO2用途非常广泛,工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下:
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式 ,酸浸时为了提高浸出率,可以采取的措施有 (任写二种)。
(2)钛铁精矿酸浸后冷却、结晶得到的副产物A为 ,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: , 。
甲烷的氯化反应式为:
(1)在链增长的第二部反应中形成的化合物的电子式为;
(2)在反应机理的三个阶段破坏或形成的化学键类型均为;
(3)在短周期主族元素中,氯元素及与其相邻元素的电负性有大到小的顺序是(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第周期族。
(4)链引发的反应为;链终止的反应为(填“吸热”或“放热”)
(5)卤素单质及化合物在许多物质上都存在着递变规律。下列有关说法正确的是。
a.相同条件下卤化银的Ksp按AgCl、AgBr、AgI 的顺序依次增大
b.卤化氢溶入水的酸性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质氧化性按F2、Cl2、Br2、I2的顺序依次减弱
(6)卤化氢的键能与键长大小如下表。
| HF |
HCl |
HBr |
HI |
|
| 键能/kJ·mol-1 |
568.6 |
431.8 |
365.7 |
298.7 |
| 键长/pm |
92 |
127.6 |
141.0 |
162 |
由上表数据可以推断:
①卤素单质非金属性越强,与氢化合生成的氢化物越(填“稳定”或“不稳定”)。
②卤化氢的键长与卤离子的半径的关系是:。
下图所示物质中,只有X是单质,常温下A和B呈气态,且B是导致酸雨的大气污染物,D是淡黄色固体。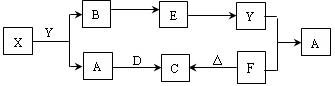
据此回答下列问题:
(1)元素X在元素周期表中位于周期族。
(2)物质D的电子式为,其阴阳离子个数比为。
(3)请列举物质F的两种用途:、。
(4)写出X和Y反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出Y和F反应的离子方程式。
A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(1)A、D元素的名称分别为AD。
(2)写出Y水解的离子方程式。
(3)将9g B单质在空气中完全燃烧,将燃烧后的气体缓慢通入1L1 mol·L-1的NaOH溶液中,充分吸收后,最终所得溶液中各离子浓度由大到小的顺序是:
。
(4)在101k Pa时,1gX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6KJ的热量,该反应的热化学方程式为:
。
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是____________________。
此液体具有的性质是__________(填字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是________________________________。
自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取纳米级TiO2的流程如下:
(1)Ti的原子序数为22,Ti位于元素周期表中的第________周期,第______族。
(2)步骤①加铁的目的是_________________;步骤②冷却的目的是_______________。
(3)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(4)由金红石制备单质钛,涉及到的步骤为:
TiO2 TiCl4
TiCl4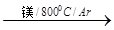 Ti
Ti
已知:①C(s)+O2(g)==CO2(g)△H= -393.5kJ·mol-1
②2CO(g)+O2(g)==2CO2(g)△H= -5665kJ·mol-1
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g)△H= +41kJ·mol-1
则TiO2(s)+ 2Cl2(g)+C(s)==TiCl4(s)+2CO(g)的△H=____________。
反应TiCl4+2Mg == 2MgCl2+Ti 在氩气氛中进行的理由是________________________。