已知:N2(g)+3H2(g)  2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :
2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :
| A.平衡时甲容器中NH3(g)的体积分数比乙容器中的小 |
| B.平衡时甲容器中气体的压强为开始时压强的 |
| C.达到平衡时,甲容器中H2的转化率为25% |
| D.Q1=Q |
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中X所处的周期序数与族序数相等。下列判断错误的是
| A.四种元素最高价氧化物对应的水化物均能与NaOH溶液反应 |
| B.气态氢化物的稳定性:Y<W |
| C.原子半径:Y>Z |
| D.含X的盐溶液一定显酸性 |
下列装置或操作能达到实验目的的是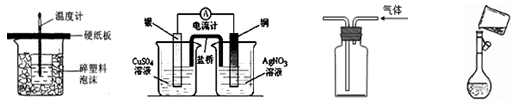
| A.中和热测定 | B.构成原电池 | C.收集氢气 | D.定容 |
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 |
结论 |
|
| A |
切开金属钠,钠表面的银白色会逐渐褪去 |
Na在空气中会生成Na2O2 |
| B |
铝箔插入浓硝酸中,无明显现象 |
铝与浓硝酸不反应 |
| C |
SO2通入酸性KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
| D |
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 |
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
Cl- |
|
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.071 |
0.099 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
-1 |
-1 |
A.A、B的单质与稀盐酸反应速率B>A
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4