某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
| A.[(b-a)/84]×22.4×1000 mL |
| B.[(b-c)/31]×22.4×1000 mL |
| C.[(c-a)/106]×22.4×1000 mL |
| D.[(c-a)/106]×2×22.4×1000 mL |
某学生课外活动小组利用下图所示装置分别做如下实验: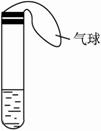
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
(14分)用电解方法制取金属镁时需要用无水MgCl2,而直接加热MgCl2·6H2O晶体却得不到无水MgCl2。某化学小组利用下图实验装置(夹持装置已略去),通过测定反应物及生成物的质量来确定MgCl2·6H2O晶体受热分解的产物。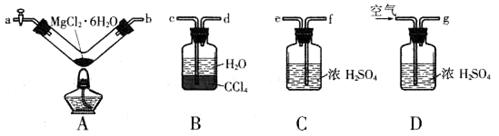
请回答:
(1)按气流方向连接各装置,其顺序为_______(填仪器接口字母编号)。
(2)实验过程中,装置B中的CCl4层始终为无色。装置B的作用为________。实验结束后,需通入一段儿时间的空气,其目的为_______
(3)实验中称取8.12 g MgCl2•6H20晶体,充分反应后,装置A中残留固体质量为3.06 g, 装置B增重1.46 g,装置C增重3.60 g。则装置A中发生反应的化学方程式为____________
(4)直接加热MgCl2·6H2O晶体得不到无水MgCl2的原因为____________________________。
(5)某同学采用下图装置(夹持装置已略去)由MgCl2·6H2O晶体制得了无水MgCl2。
①方框中所缺装置从上图A、B、C、D中选择,按气流方向连接依次为_______(只填仪器字母编号,不必填接口顺序)
②圆底烧瓶中盛装的液体甲为_______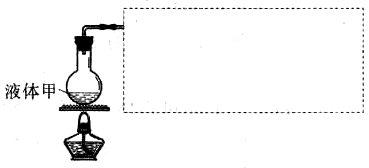
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用式滴定管盛装1.00mol/L盐酸标准液。下图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
8.2—10.0 |
该实验不可选用 作指示剂;若使用酚酞做指示剂滴定终点为__________________
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
20 |
0.50 |
25.12 |
24.62 |
| 2 |
20 |
如图 |
如图 |
填写_______ |
| 3 |
20 |
6.00 |
30.58 |
24.58 |
(2)根据所给数据,计算出烧碱样品中NaOH的物质的量浓度mol/L
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
e.未用标准液润洗酸式滴定管
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。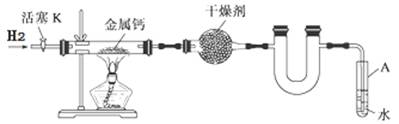
(1)试管A的作用有;。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
②;
③点燃酒精灯,进行反应;
④反应结束后,;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、;
②判断滴定终点的方法是;
③产品中两种成分物质的量之比为。
[化学——选修5:有机化学基础](15分)
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: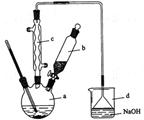
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式。继续滴加至液溴滴完。装置d中NaOH溶液的作用是。
(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为(填序号)。
A.>156℃B.59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。
此操作所需要的玻璃仪器除烧杯外,还需,用NaOH溶液洗涤的作用是;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是(填入字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取