某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是: ;
(4)如下图是某次滴定时的滴定管中的液面,其读数为 mL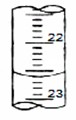
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol·L-1
| 滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:SO2(g)+Cl2(g)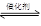 SO2Cl2(l) △H=-97.3kJ/mol。
SO2Cl2(l) △H=-97.3kJ/mol。
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)装置甲中仪器A的名称为______,甲中活性炭的作用是________,B的作用为;
(2)装置丁中发生反应的离子方程式为;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为,分离产物的方法是(填字母);
| A.重结晶 | B.过滤 | C.蒸馏 | D.萃取 |
(4)装置丙的作用为,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为;
(5)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
冰晶石是一种矿物,主要成分为六氟合铝酸钠(Na3AlF6),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂,制造乳白色玻璃和搪瓷的遮光剂。工业上生产Na3AlF6的主要流程如下: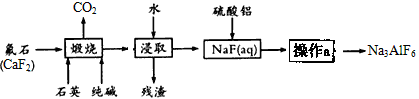
试结合生产流程回答下列问题:
(1)浸取后的“残渣”中一定含有的成分是________,硫酸铝与NaF(aq)反应的离子方程式为____;
(2)为提高NaF的浸出率,煅烧后的固体在浸取前应采取的措施为,为得到纯净的Na3AlF6产品,操作a包括的主要操作步骤为→→;
(3)在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,请解释其原因是;
(4)78kg含CaF280%的氟石(杂质不含氟元素)理论上可生产Na3AlF6______kg(设生产过程中的每一步含氟物质均完全转化);
(5)碳酸化法也是工业制取Na3AlF6的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式_____________。
实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1—溴丁烷(CH3CH2CH2CH2Br)的反应原理如下
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是。(填字母)
a.圆底烧瓶b.量筒c.温度计d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是。
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是。
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,
1-溴丁烷在(填“上层”、“下层”或“不分层”),加入NaHSO3溶液的目的是。
(5)将实验(4)所得的1-溴丁烷粗产品干燥后,进行操作,即可得到纯净的1-溴丁烷。
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4 g.NaBr13.0 g,最终制得1-溴丁烷9.6 g,则1-溴丁烷的产率是。(保留2位有效数字)
某学习小组设计实验,探究二氧化硫的漂白性和还原性。
(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是。
②足量碱石灰的作用是。
甲同学由此得出的实验结论是。
(2)还原性:
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是,检验该反应所得含氧酸根离子的方法是。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3溶液形成的混合色。 则②中红棕色变为浅绿色的原因是。
乙同学得出的实验结论是:二氧化硫可还原三氯化铁。
碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物。工业上利用废铁屑(含少量氧化铝、氧化铁等),生产碱式硫酸铁的部分工艺如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)反应I中发生的氧化还原反应的离子方程式是__________。
(2)反应II中加入NaHCO3调节体系的pH在____范围内。
(3)反应III中生成的气体遇空气变红棕色,则III中发生反应的离子方程式是_________ 。
(4)反应III中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=____mol。
(5)用硫酸可知体系的pH。若硫酸加入量过小,溶液生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是_________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可发生水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式是____________。