实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如下图,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm,3沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。请回答以下问题:
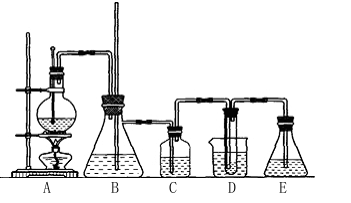
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入 。
烧瓶内发生的反应的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中盛有10%的NaOH溶液,其作用是 。
(4)装置D中试管中装有液溴,实验开始后观察到的主要现象是 。
(5)开始反应时需向装置D中的烧杯里加入冰水,这是为了 。
(6)装置E的作用 。
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
|
金属离子 |
|
|
|
|
|
|
|
|
开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
|
沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(K a约为10 −4, 易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒________。
(2)提取过程不可选用明火直接加热,原因是________,与常规的萃取相比,采用索氏提取器的优点是________。
(3)提取液需经"蒸馏浓缩"除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是________。"蒸发浓缩"需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是________ 和吸收________
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________。

环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:  (g) =
(g) =  (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) =  (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(  )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。


该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:

①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。

① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。