高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
某学生采用下面的装置及实验方法来测定推断乙醇的分子结构。
(1)该学生分别准备称取4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况下的体积都小于1.12 L。若忽略量筒本身及读数造成的误差,那么该学生认为是由于样品中含有少量水造成的,你认为正确吗?_________________(填“正确”或“不正确”)。如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?
____________________________________________________________。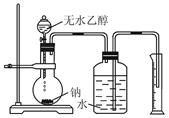
(2)该学生认为实验成功的关键有:
①装置气密性良好 ②实验开始前要准确确定乙醇的量 ③钠足量 ④广口瓶内必须充满水 ⑤氢气的体积测算方法正确、数据准确
你认为,其中正确的有_______________(填序号)。
(3)实验后,该学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,若乙醇的物质的量为n mol,则对钠的物质的量取值要求必须是________________。
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取W g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置
进行实验:
回答下列有关问题:
(1)E装置的作用是___________________________________________________________。
(2)需要加热的装置是_________________________________________________________。
(3)写出氨基酸燃烧的方程式___________________________________________________。
(4)D的作用是_______________________________________________________________。
(5)F处读数时应注意的问题:_________________________________________________。
(6)还须测定的数据有_________________________________________________________。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
B.R—OH(R是一个含C、H、O的基团)
(1)A可在无机酸催化下水解,其反应方程式是___________________________________。
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母)_______位。
(3)写出ROH的分子式:____________。
(12分)如图所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,玻璃管B中装有CuO(用石棉绒作载体)。请回答下列问题:
(1)向试管A中鼓入空气的目的是___________________________________________。
(2)试管A上部放置铜丝的作用是___________________________________________。
(3)玻璃管中可观察到的现象是_____________________________________;相关化学方程式是____________________________________________________________________。
(4)试管C中放的是蒸馏水,在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是__________________。
(6分)中国在新工业化发展过程中,开发可再生能源以缓解石油短缺引起的能源危机是一个重要的课题。2003年元月份,辽宁省投资建设一个年产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量。已知制酒精的方法有三种:
方法一:在催化剂作用下乙烯与水反应
方法二:CH3-CH2Br + H2O CH3CH2OH + HBr
CH3CH2OH + HBr
方法三:(C6H10O5)n(淀粉)+nH2O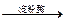 nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
C6H12O6(葡萄糖)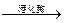 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
(1)你认为应用哪一种方法生产工业酒精能够缓解石油短缺带来的能源危机?为什么?
(2)方法一的化学反应方程式是:_________________________________________________。
(3)乙醇燃烧的化学方程式是:__________________________________________________。