环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:  (g) =
(g) =  (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) =  (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(  )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。


该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
(14分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 分组实验 |
催化剂 |
|
| ① |
10mL 5% H2O2溶液 |
无 |
| ② |
10mL 2% H2O2溶液 |
无 |
| ③ |
10mL 5% H2O2溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ④ |
10mL 5%H2O2溶液+少量HCl溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ⑤ |
10mL 5% H2O2溶液+少量NaOH溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: 环境能增大H2O2分解的速率; 环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)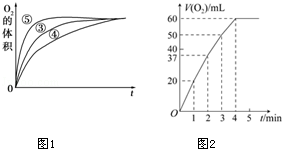
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】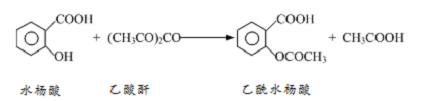
【物质性质】
【实验流程】
(1)物质制备:向大试管中依次加入2 g水杨酸、5 mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10 min。装置如下图: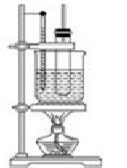
(2)产品结晶:取下大试管,置于冷水中冷却10 min。待晶体完全析出,……抽滤,再洗涤晶体,抽干。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸1.8 g。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。
【问题讨论】
1、写出水杨酸与碳酸氢钠溶液反应的化学反应方程式 。
2、写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式 。
3、流程(1)装置图中长导管的作用 。
4、控制反应温度85℃~90℃的原因 。
5、流程(2)中证明晶体洗涤干净的操作方法: 。
6、流程(4)中溶液显紫色,可能的原因是 。
7、1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗 mol NaOH。
8、实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下: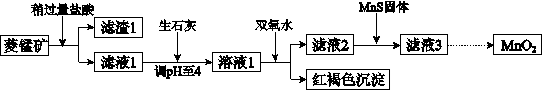
已知:生成氢氧化物沉淀的pH
| Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
|
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。
盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是 。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□____=□____+□____+□____。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的________和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。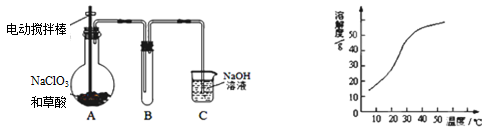
反应过程中需要对A容器进行加热,加热的方式为____________;加热需要的玻璃仪器除酒精灯外,还有 ;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
① ;② ;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶。请按要求填空:
(1)所需浓H2SO4的体积为 。
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。·
(3)除量筒和胶头滴管外还需用到的玻璃仪器有: 。
(4)洗涤操作一般要求重复 次,且洗涤液均要 。
(5)定容的操作为:向容量瓶中加入蒸馏水,至液面离刻度线 处,改用胶头滴管滴加,至 。