锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,
且对环境无污染。电池总反应式为:V2O5+xLi==LixV2O5。下列说法中,不正确的是( )
| A.正极材料为锂,负极材料为V2O5 |
| B.向外供电时,锂离子在凝胶中向正极移动 |
| C.正极的电极反应式为:V2O5 + xLi++ xe—="=" LixV2O5 |
| D.负极的电极反应式为:xLi—xe—==xLi+ |
下列溶液中,微粒浓度关系正确的是( )
| A.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度可能是c(Cl-)> c(NH4+)>c(OH-)>c(H+) |
| B.常温下pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.1 mol·L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.常温下pH=3的一元酸和pH=11的一元碱等体积混合后的溶液中一定是c(OH-)=c(H+) |
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是()
| A.氨水的浓度等于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1 |
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是( )
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 | B.水的电离程度增大 |
| C.Kw逐渐减小 | D.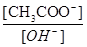 变大 变大 |
对水的电离平衡不产生影响的粒子是( )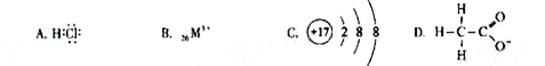
常温下,下列各组比值为1∶2的是()
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比 |