下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①②⑦ | B.②③⑤ | C.③④⑥ | D.①④ |
密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是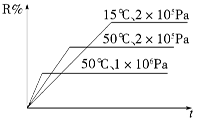
| A.正反应吸热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应放热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.通入少量HCl气体,溶液中PH值增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列各电离方程式中,书写正确的是
| A.CH3COOH === H++CH3COO- | B.KHSO4  K++H++SO42- K++H++SO42- |
C.Al(OH)3 Al3++3OH- Al3++3OH- |
D.NaH2PO4  Na++H2PO4- Na++H2PO4- |
属于强电解质的是①NaOH ②NH3·H2O ③CaCO3 ④CH3COOH⑤NaHCO3⑥氢氧化铝⑦氯化铵⑧二氧化碳⑨乙醇⑩铜
| A.①③⑤⑦ | B.②④⑥⑦ | C.①③⑥⑦ | D.⑧⑨⑩ |