(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
(已知:①CO(g)+ 1/2O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1 )
此反应的热化学方程式是 。
(2)硫—碘循环分解水制氢,主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI II 2HI H2+I2
H2+I2
III 2H2SO4====2SO2+O2+2H2O
分析上述反应,下列判断正确的是 。、
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1 molH2
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为 。
(5)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
上述冶炼过程产生大量SO2。下列处理SO2的方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
已知碳与氯气很难直接化合,请你推测CH4在Cl2中燃烧的方程式:__________________。
把下列14种能源按要求填入下表,并指出哪些是不可再生能源。
煤、石油、水力、汽油、铀、薪柴、酒精、天然气、液化气、热水、煤气、蒸汽、风力、电。
| 一次能源 |
二次能源 |
|
| 燃料能源 |
||
| 非燃料能源 |
(1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质,其原因是_____________________________。
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
电解原理在化学工业中有广泛应用。图2-20表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: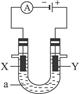
图2-20
若X、Y都是惰性电极,a是氯化钠饱和溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
(1)电解池中X极上的电极反应式为_____________________,在X极附近观察到的现象_____________________________________________________________________________。
(2)Y电极上的电极反应式为____________________________,检验该电极反应产物的方法是____________________________________________________________。
矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土〔Al2Si2O5(OH)4〕,此反应的离子方程式为2KAlSi3O8+2CO2+11H2O====2K++2 +4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
+4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。