20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度。
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________,
②所得溶液中的物料守恒式为:________+________=__________=_________mol•L-1。
③c(CH3COOH)=_____________mol•L-1(写出算式,不做近似计算)
(15分) [选修2—化学与技术]氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。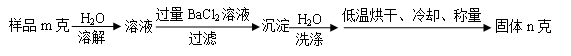
①检验沉淀是否洗涤干净的方法是_____________。
②样品中NaCl的质量分数的数学表达式为________________。
(9分) 粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示: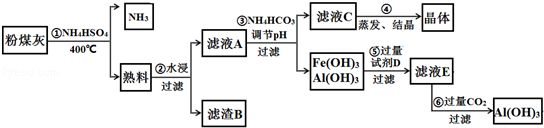
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式 。在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2不属于 (填字母)。
a.硫酸盐 b.复盐c.强电解质d.共价化合物
(2)滤渣B的主要成分为 。
(3)已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-32。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5 mol•L﹣1可认为完全沉淀,则溶液A至少应调节到pH=___。
(4)实验室进行第④步操作时,所需的主要仪器是酒精灯、三脚架、 、 ,得到的晶体主要成份是 (填化学式)。
(8分) 乙苯催化脱氢制苯乙烯反应: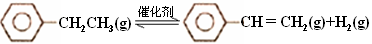
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=___________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 ___________。
②控制反应温度为600℃的理由是____________。
(8分) 已知:25℃时,
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
HNO2 Ka=5.1×10-4
HClO Ka=3.0×10-8
饱和NaClO溶液的浓度约为3 mol/L。
(1)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
(2)下列离子反应错误的是:_____________。
A.2HCO3-+SO2= SO32-+2CO2+ H2O
B.ClO-+CO2+ H2O=" HClO+" HCO3-
C.ClO-+SO2+ H2O=" HClO+" HSO3-
D.2ClO-+SO2+ H2O=" 2HClO+" SO32-
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是:_________。
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用: H++ ClO-= HClO
(4)25℃时,0.1 mol下列气体分别与1 L0.l mol·L-1的NaOH溶液反应,形成的溶液pH由大到小的顺序为:__________(用A、B、C、D表示)。
A.NO2B.SO2 C.SO3D.CO2
【选修5:有机化学基础】以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮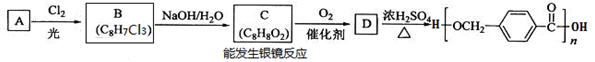
请根据以上信息回答下列问题:
(1)烃A的结构简式为 ,A的化学名称为__________。
(2)由B生成C的化学方程式为 。
(3)C的同分异构体中,既能与FeCl3溶液发生显色反应,又能发生银镜反应的有机物共有______种,其中在核磁共振氢谱中出现五组峰的有机物的结构简式为_________。
(4)D的结构简式为 ,D的某同分异构体中含有苯环的碳酸二酯在酸性条件下发生水解反应的化学方程式为 。