25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )
| A.a<7时,水的电离受到抑制 | B.a>7时,水的电离被促进了 |
| C.a<7时,溶液的pH一定为a | D.a>7时,溶液的pH一定为14-a |
阿魏酸在食品、医药等方面有若广泛用途。一种合成阿魏酸的反应可表示为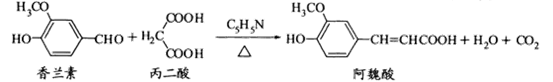
下列说法正确的是
| A.香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
B.香兰素、阿魏酸均可与NaHCO3、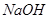 溶液反应 溶液反应 |
| C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物有2种 |
下列有机物命名正确的是
| A.(CH3)3CCH2C(CH3)=CH2的名称为:2,2,4-三甲基-4-戊烯 |
B.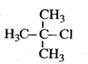 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
C. 2-甲基-1-丙醇 2-甲基-1-丙醇 |
D.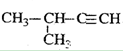 2-甲基-3-丁炔 2-甲基-3-丁炔 |
下列图示与对应的叙述相符的是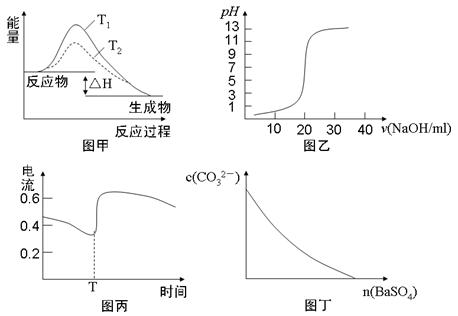
| A.图甲表示T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
在某些化学知识用数轴表示能体现出直观形象、简明易记的特点。下列用数轴表示正确的是
A.平衡常数与转化率关系: |
B.Cl2与CH4取代反应后的产物: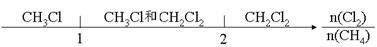 |
C.25℃时,不同pH值的溶液中,水的电离度: |
D.AlCl3和NaOH反应铝元素的存在形式: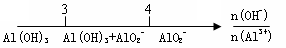 |
合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。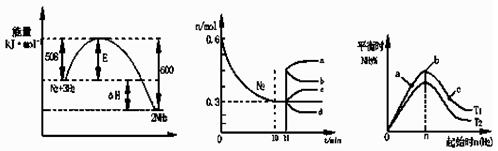
图1图2图3
下列说法正确的是:
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |