常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是( )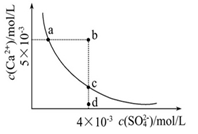
| A.常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/L Na2SO4溶液后,溶液中无沉淀析出 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
D.a 点对应的Ksp等于c点对应的Ksp 点对应的Ksp等于c点对应的Ksp |
根据右图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是 ( )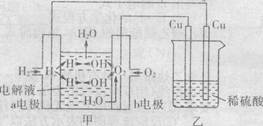
| A.甲是一种具有应用前景的绿色电源 |
| B.甲中b电极的电极反应为:40H-一4e=2H20+02↑ |
C.通电初期乙中的总反应为:Cu + H2SO4 |
| D.反应过程中甲、乙装置的pH都逐渐减小 |
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
| A.12g镁在空气中完全燃烧失去的电子数为NA |
| B.用粗铜作阳极电解稀硫酸,当生成0.1molH2时,阳极失去的电子数为0.1 NA |
| C.标准状况下,22.4LSO3所含的分子数约为NA |
| D.有1 molCH3COO-的醋酸钠溶液中Na+数目等于NA |
已知A~G都是中学化学中的常见物质,其中A是固体单质,C 是气体单质,E是氧化物,它们之间的转化关系如右图所示(图中部分产物及反应条件没有列出)。据此判断下列说法正确的是( )
| A.A一定是金属,C一定是氧气 |
| B.A一定是非金属,B可能是NaOH |
| C.在通常情况下,物质E的熔点可能很高 |
| D.图中所涉及的反应只有置换反应、复分解反应 |
短周期元素甲、乙、丙,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素的最高正价和最低负价的代数和等于4。则下列判断不正确的是 ( )
| A.丙元素的族序数比甲元素的大. |
| B.原子半径从大到小的顺序:甲>乙 |
| C.甲的最高价氧化物的水化物的酸性比硝酸的强 |
| D.乙、丙元素的气态氢化物的热稳定性:乙>丙 ’ |
下列相关实验现象的分析中,错误的是 ( )
| A.在铜锌原电池中,锌片上也有气泡可能是因为锌片中含有杂质 |
| B.向酸性KMn04溶液中通入乙炔,溶液长时间不褪色可能是因为溶液浓度太大 |
| C.用标准NaOH溶液滴定盐酸,测得盐酸的浓度偏大,可能是先用待溅液润洗了锥形瓶 |
| D.将Ba(OH)2·8H20和NH4Cl混合搅拌,无明显降温现象,.可能是因所用的反应物是晶体 |