原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,W的单质为淡黄色固体,Y、Z左右相邻,Z、W位于同主族。
⑴ X元素是 ;W的原子结构示意图 。
⑵ X与W组成的化合物中存在 键(填“离子”“共价”)。
⑶ Y、Z形成的简单离子的半径由大到小的顺序为 。
⑷工业上由X的单质与Y的单质化合生成1molA气体时放出46.2kJ的热量,写出该反应的热化学方程式 。
⑸由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时 间白色沉淀变为灰绿色,最终变为红褐色;
间白色沉淀变为灰绿色,最终变为红褐色;
b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 。
② 已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式。步骤①中加入足量铁屑的目的是。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。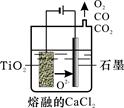
(3)步骤②的离子方程式是,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是。
(5)乳酸可由乙烯经下列步骤合成:
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468kg乳酸亚铁晶体(M=234g/mol)需要标准状况下的乙烯m3。
有机物G是制备液晶材料的中间体之一,其结构简式为: G的一种合成路线如下:
G的一种合成路线如下:
其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是;C中官能团的名称是。
(2)B的名称是。第①~⑦步中属于取代反应的有(填步骤编号)。
(3)写出反应⑤的化学方程式:。
(4)第⑦步反应的化学方程式是。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式。
a.苯环上的一氯代物有2种;b.水解生成二元羧酸和醇。
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增。X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子。
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于______区元素,Y、Z、D三种元素中电负性由小到大的顺序是_________。
(2)X3D+的中心原子杂化轨道类型是__________,该离子的立体构型是。
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是。
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是。
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
(1)G中所含的官能团除苯环外,还有________________。
(2)写出反应类型。反应 ① ___________;反应 ③ ____________。
(3)写出结构简式。A ______________;F ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
(6)最常见的聚碳酸酯是用双酚A( )与光气(
)与光气( )聚合得到,请写出该聚碳酸酯的结构简式______________________________。
)聚合得到,请写出该聚碳酸酯的结构简式______________________________。
已知:
烃A与氢气以物质的量1:1发生加成反应时可以得到多种产物,以下是其中两种产物的结构简式:
| 产物 |
① |
② |
| 结构简式 |
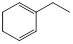 |
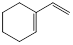 |
(1)除了上述加成产物外,请写出其他加成产物的结构简式:___________(不考虑立体异构)。
(2)鉴别A与其属于芳香烃的同分异构体的试剂是________________(写化学式)。
(3)已知环外双键活泼性高于环内双键,写出产物 ② 发生聚合反应所得产物的结构简式。
_________________。
(4)双烯合成反应过程如下所示:
写出产物 ② 与乙烯发生双烯合成反应产物的结构简式:______________。
(5)以产物 ① 为原料通过三步反应可以转化为2-氯-3-乙基-1,4-环己二醇。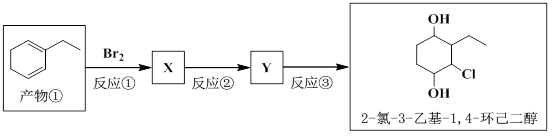
写出反应 ② 的化学方程式。_____________________。