如图所示是298 K时N2与H2反应过程中 ,能量变化的
曲线图.下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2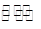 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ, |
若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。如表中由实验现象得出的结论完全正确的是
| 选项 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液变红色 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH的溶液褪色 |
Cl2具有酸性 |
| C |
石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
| D |
淀粉KI溶液中变为蓝色 |
Cl2具有氧化性 |
下列有关硅的叙述中,正确的是
| A.工业上通常以SiO2为原料,用氧化剂与其反应制备单质硅 |
| B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一 位 |
| C.硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D.硅在电子工业中,是重要的半导体材料 |
为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
| 实验操作 |
实验现象 |
离子反应 |
实验结论 |
|
| A |
在氯化亚铁溶液中滴加新制氯水 |
浅绿色溶液变成棕黄色溶液 |
2Fe2++Cl2=== 2Fe3++2Cl- |
Fe2+具有还原性 |
| B |
在氯化亚铁溶液中加入锌片 |
浅绿色溶液变成无色溶液 |
Fe2++Zn=== Fe+Zn2+ |
Zn具有还原性 |
| C |
在氯化铁溶液中加入铁粉 |
棕黄色溶液变成浅绿色溶液 |
Fe3++Fe=== 2Fe2+ |
铁单质具有还原性 |
| D |
在氯化铁溶液中加入铜粉 |
蓝色溶液变成棕黄色溶液 |
2Fe3++Cu=== 2Fe2++Cu2+ |
Fe3+具有氧化性 |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO 全部转化成BaSO4沉淀,此时铝元素的存在形式是
全部转化成BaSO4沉淀,此时铝元素的存在形式是
A.Al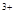 |
B.Al(OH)3 | C.AlO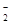 |
D.Al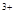 和Al(OH)3 和Al(OH)3 |