常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
| A.溶液中由水电离产生的H+浓度为1×10-7 mol/L |
| B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L |
| C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度 |
| D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1);ΔH=﹣57.3KJ•mol-1
已知:(aq)+NaOH(aq)= CH3COONa(aq)+H2O(1);ΔH1
1/2H2SO4(浓)+ NaOH(aq)= 1/2Na2SO4(aq)+H2O(1);ΔH2
HNO3(aq)+ KOH(aq)=KNO3(aq)+H2O(1);ΔH3
上述反应均为在溶液中的反应,则ΔH1、ΔH2、ΔH3的关系正确的是
| A.ΔH1=ΔH2=ΔH3 | B.ΔH2<ΔH1<ΔH3 |
| C.ΔH2<ΔH3<ΔH1 | D.ΔH2=ΔH3<ΔH1 |
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1
C(s)+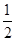 O2(g)===CO(g);△H2
O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3
S(g)+O2(g)===SO2(g);△H4
③H2(g)+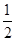 O2(g)===H2O(l);△H5
O2(g)===H2O(l);△H5
2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7
CaO(s)+H2O(l)===Ca(OH)2(s);△H8
| A.① | B.④ | C.②③④ | D.①②③ |
下图是温度和压强对X+Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是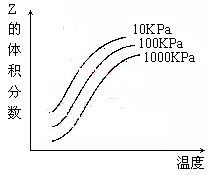
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种是气态,Z为气态 |
| D.上述反应的逆反应的△H>0 |
常温下,向10mL pH=10的KOH溶液中加入pH=4的一元酸HA的溶液至pH刚好等于7(假设反应体积不变),则对反应后溶液的叙述错误的是
| A.c(A-)=c(K+) |
| B.c(K+)+c(H+)=c(OH-)+c(A-) |
| C.c(H+)=c(OH-)<c(K+)<c(A-) |
| D.V总≤20mL |
把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是
| A.自来水 | B.0.5mol/L盐酸 |
| C.0.5mol/L HAc溶液 | D.0.5mol/LKCl溶液 |