下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1
C(s)+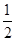 O2(g)===CO(g);△H2
O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3
S(g)+O2(g)===SO2(g);△H4
③H2(g)+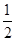 O2(g)===H2O(l);△H5
O2(g)===H2O(l);△H5
2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7
CaO(s)+H2O(l)===Ca(OH)2(s);△H8
| A.① | B.④ | C.②③④ | D.①②③ |