在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,
2NO2(g)体系中,
n(NO) 随时间的变 化如下表:
化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= ,
已知:K(300℃)>K(350℃),该反应是 反应(填“放热”或“吸热”);
(2)右图中表示NO2的变化的曲线是 ,用O2的浓度变化表示从
0~2s内该反应的平均速率υ= ;
(3)能说明该反应已经达到平衡状态的是________________
a. υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)若将容器体积缩小至1L,反应达到平衡时的平衡常数 (填“增大”、“减小”或“不变”)。
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下: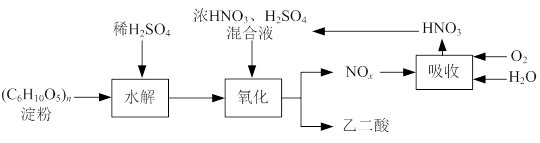
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
⑴检验氧化后的溶液中是否仍含有葡萄糖的实验方案为。
⑵氧化时控制反应液温度为55~60℃的原因是。
⑶若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为。
⑷生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行。已知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。
回答:
(1)A为________元素,B为________元素,C为________元素,D为________元素。
(2)C元素在周期表中属________周期________族元素,其原子电子排布式为________。
(3)B与C形成的非极性分子的电子式是________。其中共价键类型及数目是________。(填σ键或π键)
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。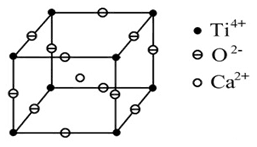
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 ,该物质的化学式可为 。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),阿伏加德罗常数为6.02×1023 mol-1,则该晶体的密度为 g·cm-3。
石墨的片层结构如图所示,试完成下列各题:
(1)平均 个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是 。
某有机物的结构式如下: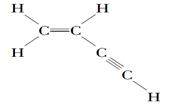
则分子中有________个σ键,________个π键。