阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行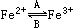 的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)已知:氧化性Cl2> Br2> Fe3+, 还原性Fe2+>Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是(填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-−2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为;将电解后的溶液加水稀释至1L,此时溶液的pH=。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式:。
某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4∙5H2O),其实验方案如下:
请回答下列问题:
(1)将合金研磨成合金粉的目的是。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ:;
Ⅱ:。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为。
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=−1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O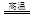 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是,若反应中转移1mol电子,得到Cumol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法(填“正确”或“不正确”),原因是
。