在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
U、V、X、Y、Z五种短周期元素,原子序数依次增大。U、V两元素最高正价与最低负价之和均为0;Y与U同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(用实际元素符号表示)________________;
(2)由这五种元素中的几种组成的化合物A、B、C、D有如下转化关系: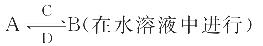
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式:___________________;
①如果B为两性不溶物,则A的化学式为_________,A转化为B的离子方程式为:____________;
②如果B由四种元素组成且溶液显碱性,则B含有的化学键类型是_______,A所属物质类别为_ ___________(填选项序号)。a.酸 b.碱 c.盐 d.氧化物
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题: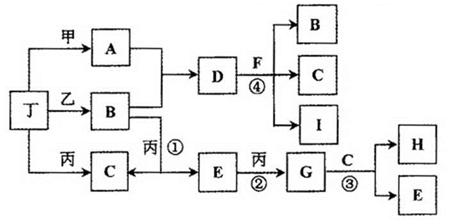
(1)反应④的化学方程式为。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B 乙+丁(未配平),达平衡后再加少量B,则平衡移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率(填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率(填“增大”、 “减小”或“不变”)。
(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示)。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是mL。
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l)△H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l)△H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素。请回答下列问题:
(1)①B在元素周期表中的位置________________________________;
②上述元素的最高价氧化物的水化物中酸性最强的是_______________(写化学式)。
(2)C、D、E、F四种元素对应的简单离子的半径由小到大的顺序是______________________________。(用离子符号表示)。
(3)A、C、D、E中的三种或四种元素形成的多种离子化合物中,溶液呈酸性的有____________(写化学式,任写一种即可);上述离子化合物中还有可以和盐酸发生氧化还原反应的,该反应的离子方程式为________________________________________。
(4)工业上常用A、B组成的物质X来检验F的单质是否发生泄漏,有大量白烟生成,写出此反应的化学反应方程式________________________________。其中该反应中还原剂和氧化剂的物质的量之比为__________________。
(5)A和C可形成两种液态化合物Y和Z,用电子式表示原子个数之比1︰1的物质Y的形成过程_____________________;在微电子工业中,X的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为_________________。
(6)某BC和BC2的混合气体,且n(BC)︰n(BC2)=1︰3,现向混合气体中补充一定量的氧气,再一起通入石灰乳中,BC和BC2恰好被吸收,生成B的最高价含氧酸盐,从而可以除去BC和BC2的混合气体。写出此吸收法除去该混合气体的总化学反应方程式:________________________________________________。