煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s) +H2O(g)  CO(g) +H2(g) △H= +131.3kJ·mol-1
CO(g) +H2(g) △H= +131.3kJ·mol-1
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1mol H-H 键断裂的同时断裂2molH-O键
c.v正(CO)= v逆(H2O) d.c(CO) =c(H2)
(2)其他条件不变,升高温度其平衡 移动,减小压强其平衡 移动。
(3)达到平衡后,改变某一外界条件(不改变H2、CO的量),反应速率v与时间t的关系如下图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。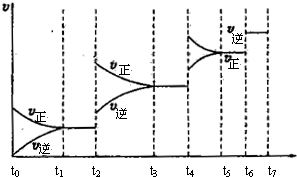
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:

请回答下列问题:
(1)美托洛尔中的含氧官能团为和(填名称)。
(2)反应③中加入的试剂X的分子式为C2H5OCl,X的结构简式为。
(3)在上述①②③三步反应中,属于取代反应的是(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢,且1 mol该物质与金属钠反应产生 1 mol H2。
写出一种该同分异构体的结构简式:。
(5)根据已有知识并结合题目所给相关信息,写出以CH3OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下: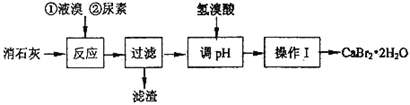
溴化钙的部分溶解度数值如下:
| 温度 |
0℃ |
10℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
| 溶解度(g) |
125 |
132 |
143 |
213 |
278 |
295 |
312 |
(1)6Ca(OH)2+6Br250~70℃5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为。
(2)过滤所需的玻璃仪器有玻璃棒、,。
(3)加入氢溴酸调pH的作用是。
(4)操作I包括、、过滤、、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。
硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:
已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.8 |
4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)。
(2)Fe粉除调pH外,另一个作用是;Fe粉调节溶液的pH为。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为;
所得滤液的主要溶质是(填化学式)。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为。
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是。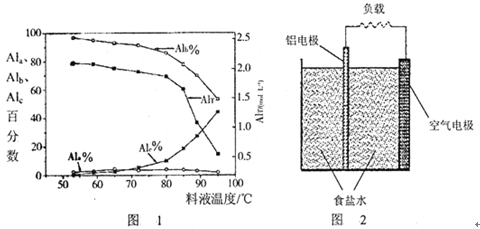
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)△H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g)△H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g)△H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式。