在100毫升某一元弱酸(Ka=10-3~10-7)的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如下图所示,下列叙述正确的是: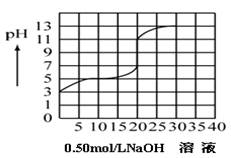
| A.该弱酸在滴定前的浓度是0.15 mol/L: |
| B.该弱酸的电离常数(Ka)是10-5 |
| C.在滴定过程,为求滴定终点,最合适的指示剂是酚酞 |
| D.在滴定过程,为求滴定终点,最合适的指示剂是甲基橙 |
下列关于反应热的表述正确的是
| A.当△H<0时,表示该反应为吸热反应 |
| B.需要加热才能进行的反应是吸热反应 |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3 |
下列溶液一定呈酸性的是
| A.含H+的溶液 | B.能使酚酞呈无色的溶液 |
| C.pH小于7的溶液 | D.c(H+)大于c(OH-)的溶液 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液 有关量或性质的变化趋势,错误的是( )
有关量或性质的变化趋势,错误的是( )
在怛容条件下化学反应: 2SO2 ( g ) + O2 ( g )  2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是()
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是()
| 容器 |
SO2 (mol) |
O2(mol) |
SO3 (mol) |
Q(kJ·mol-1) |
| 甲 |
2 |
1 |
0 |
Q1 |
| 乙 |
1 |
0.5 |
0 |
Q2 |
| 丙 |
1 |
0.5 |
1 |
Q3 |
A.在上述条件下反应生成 lmolSO3固体放热Q/2 kJ
B.2Q1 <2Q2=Q1<Q
C.Ql ="2" Q2= 2Q3 = Q
D.2Q3 < 2Q2 < Q1 < Q
可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存⑧N2、H2、NH3分子式之比为1:3:2
| A.全部 | B.只有①③⑤ | C.②③⑤⑥ | D.只有③⑤⑥ |