铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
(1)A、C的结构简式分别是________、________,D中含有的含氧官能团名称是________。
(2)C→D的反应类型是________。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是__________________________
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:___________________________________________
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式___________________________________。
华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。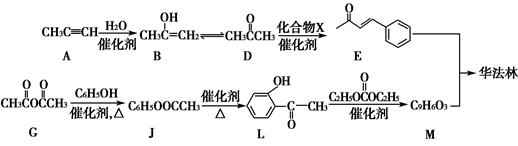
(1)A的名称为________,A→B的反应类型为________。
(2)D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为____________________________________
(3)G→J为取代反应,其另一产物分子中的官能团是________。
(4)L的同分异构体Q是芳香酸,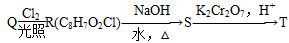 ,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为_______________________________________________________________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为_______________________________________________________________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是_________________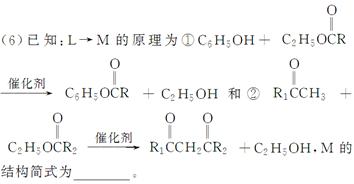
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下: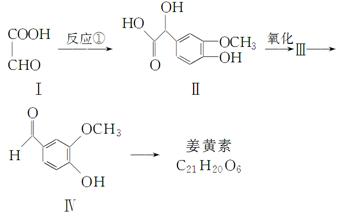
化合物Ⅰ可以由以下合成路线获得:
(1)有机物Ⅳ的分子式为________,含有官能团的名称为醚键和________。
(2)有机物Ⅴ的名称为________,其生成Ⅵ的化学方程式为(注明反应条件):_________________________________________________________________。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式
_______________________________________________________。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 mol NaOH
(4)反应①中反应物的原子利用率为100 %,请写出该反应的化学方程式
____________________________________________________________。
聚酰胺66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成: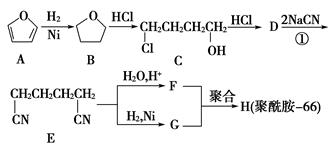
已知反应:R—CN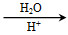 R—COOH R—CN
R—COOH R—CN R—CH2NH2
R—CH2NH2
(1)能与银氨溶液反应的B的同分异构体的结构简式为________。
(2)D的结构简式为________;①的反应类型为______________。
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及________。
(4)由F和G生成H的反应方程式为________________________________
_______________________________________________________________。
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC3—的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。