夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素, A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为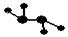 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题: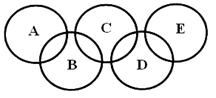
①B的水溶液呈弱酸性,是二元弱酸,其主要的电离方程式可表示为__________
D的化学式是_____ ____。②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式
。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N。
核能源已日益成为当今世界的主要能源。
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2 (CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如右图),则UO2晶体U4+的配位数为 ;
 |
三碳酸铀酰铵中含有化学键类型有;
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 |
(2)为了获得高浓度的235U,科学家们采用“气体扩散法”,到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于
晶体。’
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以作为核爆炸或核反应堆泄漏事故的信号核素。写出131I基态原子的价电子排布式 。
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:;
(2)写出“联合制碱法”有关反应的化学方程式
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于,“氨碱法”中CO2来源于。
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的 原因是。
原因是。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
(3)在硝酸铜溶液中,各种离子浓度由大到小的顺序是。
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: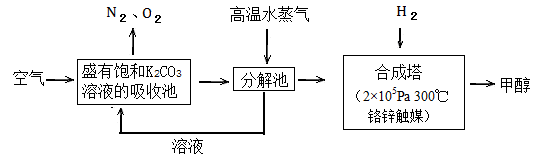
(1)写出吸收池中主要反应的离子方程式;
在合成塔中,若有2.2kgCO2与足量H2 恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)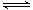 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是 (答出两点即可)。
(答出两点即可)。
D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图: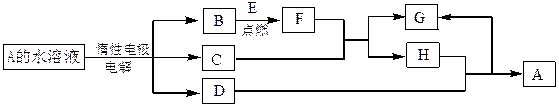 (1)B的同素异形体的名称为_________;F的化学式为__________。
(1)B的同素异形体的名称为_________;F的化学式为__________。
(2)写出D与C的浓溶液反应的化学方程式。
(3)用惰性电极电解A 溶液的阳极反应式为____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是_________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准 状况下的气体体积为_____________。
状况下的气体体积为_____________。