现有五种离子化合物A、B、C、D和E,都是由下表中的离子形成的:
| 阳离子 |
Ag+ |
Ba2+ |
Al3+ |
| 阴离子 |
OH- |
Cl- |
SO42- |
为鉴别它们,分别完成以下实验,其结果是:
①B和D都不溶于水,也不溶于酸;
②A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量的氨水反应生成白色沉淀;
③C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量的氨水过量反应生成白色沉淀;
④E溶于水后,与上述某阴离子反应可生成B;
⑤A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,写出下列物质的化学式:
A__________,B ,C_________,D__________,E__________。
右图为番茄电池,下列说法正确的是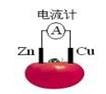
A.一段时间后, 锌片质量会变小 锌片质量会变小 |
B.铜电极附近会出现蓝色 |
| C.电子由铜通过导线流向锌 | D.锌电极是该电池的正极 |
有A、B、C、D四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A单质的还原性比B单质的还原性强,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是D
A.B>A>C>D B.B>A>D>C C.A>B>C>D D.C>B>A>D
可逆反应2NO2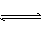 2NO+O2在恒温恒容的密闭容器中,达到平衡状态的标志是()
2NO+O2在恒温恒容的密闭容器中,达到平衡状态的标志是()
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生
②单位时间内生成n mol O2的同时生 成2n mol NO
成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③ ④⑤ ④⑤ |
B.②③⑤⑦ | C.①④⑥⑦ | D.全部 |
下列各项中前后两个叙述都正确的是()
| A.单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 |
| B.非极性键可以存在于离子化合物中;质子数相同的粒子不一定属于同种元素 |
| C.同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 |
| D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
下列物质中含有非极性键的共价化合物是()
| A.H2O2 | B.CH4 | C.Na2O2 | D.I2 |