利用低温技术可用于处理废气中的氮氧化物。在恒容密闭容器中发生下列化学反应: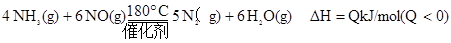 ,有关说法正确的是
,有关说法正确的是
A. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
B.平衡时,其他条件不变,增加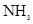 的浓度,废气中NO的转化率减
的浓度,废气中NO的转化率减 小
小
C.单位时间内生成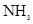 和
和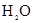 的物质的量比为2:3时,反应达到平衡
的物质的量比为2:3时,反应达到平衡
平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是:
 ①微粒半径:S2->Cl->Ca2+>K+②氢化物稳定性:HF>HCl>H2S>H2Se
①微粒半径:S2->Cl->Ca2+>K+②氢化物稳定性:HF>HCl>H2S>H2Se  ③还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te
③还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4⑥得电子能力:F>Cl>Br>I
| A.②④⑥ | B.①③④ | C.只有① | D.只有⑥ |
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。下列对于反应 2SO2+O2
2SO2+O2 2SO3的说法中正确的是:
2SO3的说法中正确的是:
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多 |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
下列叙述中,甲金属一定比乙金属活泼性强的是:
| A.甲原子电子层数比乙原子的电子层数多 |
| B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极 |
| C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙 |
| D.常温时,甲能从水中置换出氢,而乙不能 |
下列条件下的反应,放出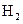 最快的是:
最快的是:
| 金属(粉末状)/mol |
酸的浓度和体积(mL) |
反应温度 |
|||
| A |
Mg |
0.1 |
3mol/LH2SO4 |
10 |
20℃ |
| B |
Al |
0.1 |
3mol/LHCl |
10 |
20℃ |
| C |
Zn |
0.1 |
3mol/LCH3COOH |
10 |
20℃ |
| D |
Fe |
0.1 |
6mol/LHNO3 |
10 |
20℃ |
下列关于可逆反应的叙述正确的是( )
| A.可逆反应是指既能向正反应方向进行,同时又能向逆反应方向进行的反应 |
B.2H2O 2H2+O2与2H2+O2 2H2+O2与2H2+O2 2H2O互为可逆反应 2H2O互为可逆反应 |
| C.对于可逆反应,当正反应速率增大时,逆反应速率就会减小 |
| D.外界条件对可逆反应的正、逆反应速率影响的程度不一定相同 |