下列条件下的反应,放出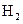 最快的是:
最快的是:
| |
金属(粉末状)/mol |
酸的浓度和体积(mL) |
反应温度 |
||
| A |
Mg |
0.1 |
3mol/LH2SO4 |
10 |
20℃ |
| B |
Al |
0.1 |
3mol/LHCl |
10 |
20℃ |
| C |
Zn |
0.1 |
3mol/LCH3COOH |
10 |
20℃ |
| D |
Fe |
0.1 |
6mol/LHNO3 |
10 |
20℃ |
用标准的盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积NaOH溶液进行滴定 |
| C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
氨水有下列平衡:NH3·H2O  NH4+ + OH– 当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是
NH4+ + OH– 当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是
| A.加NaOH | B.加盐酸 | C.加NH4Cl | D.加热 |
在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O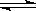 NH3·H2O+H3O+ NH3·H2O+H3O+ |
B.HCO3–+ H2O 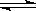 H3O+ + CO32– H3O+ + CO32– |
C.NH3 +H2O NH4+ +OH– NH4+ +OH– |
D.Cl2+H2O 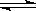 H++Cl–+HClO H++Cl–+HClO |
下列关于电解质的叙述中,正确的是
| A.碳酸钙在水中溶解度很小,其溶液的导电性很弱,所以碳酸钙是弱电解质 |
| B.氢氧化钙微溶于水,但溶解的氢氧化钙全部电离,所以氢氧化钙是强电解质 |
| C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
| D.水难电离,纯水几乎不导电,所以水是非电解质 |
铜锌原电池(如图)工作时,下列叙述错误的是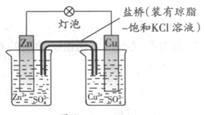
| A.正极反应为:Cu2++2e–= Cu |
| B.电池反应为:Zn+Cu2+=Zn2+ +Cu |
| C.在外电路中,电子从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |