已知固体草酸(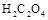 )分解的化学方程式为:
)分解的化学方程式为: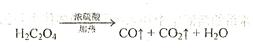
某实验小组为测定铁锈样品的组成(假定铁锈中只有 和
和 两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。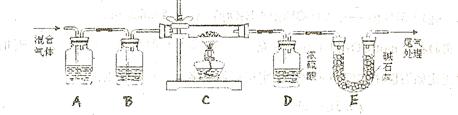
(1)为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是 、 (填答案编号)a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.氯化钙溶液
(2)在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;
(b) ;
(3)E装置的作用是 。
上述装置最后尾气处理的方法是 :
(4)准确称量样品质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n= .
(5)在本实验中,下列情况会使测定结果n偏大的是 (填答案编号)
a.缺少装置B b.缺少装置E c.反应后的固体剩余少量
(6分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
标准状况下,1.68L无色无味的可燃性气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水.得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量:_______________
(2)若原气体是单一的烃类气体,通过计算推断它的化学式:______________________
(3)若原气体是两种等物质的量的气态烃的混合物,请写出它们的结构简式(要求写出两组符合条件的物质的结构简式):______和______、________和_______
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素的最外层电子数是次外层电子数的三倍。
(1)写出实验室制取W2的离子方程式;
(2)某小组设计如图所示的实验装置图(图中夹持和加热装置略去),分别研究YX2和W2 的性质。
①分别通入YX2和W2 时,在装置A中观察到的现象是否相同(填“相同”或“不相同”)。
装置D中装的是五氧化二钒,当通入YX2时,打开K放入适量的氧气,在D装置中发生化学反应方程式为,
②若装置B中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5 mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入适量(填字母),可以看到白色沉淀产生。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
现有A、B、C、D、E五种烃,作如下实验:
(1)各取0.01mol上述五种烃,分别使之充分燃烧,其中B、C、E燃烧所得的CO2均为448mL(标况)。A、D燃烧所得的CO2都是B、C、E的三倍。
(2)在适当的条件下,A、B、C都能跟氢气发生加成反应。其中A可直接转变为D,B可转变为c或E,C可转变为E
(3)B和c都能使溴水或酸性高锰酸钾溶液褪色,而A、D、E则无此性质。
(4)用铁屑作催化剂时,A可与液态溴发生取代反应。请判断后填写下表:
| A |
B |
C |
D |
E |
|
| 结构简式 |
(10分)甲、乙、丙、丁是四种短周期元素,它们的原子序数依次增大,其中甲和丙、乙和丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
(1)写出甲、乙、丙三种元素组成的化合物的电子式________,指出其中含有的化学键的类型_______、_______。
(2)写出乙与丙按原子个数比1:1组成的化合物与水反应的化学方程式_________。
(3)用甲元素的单质与乙元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特质的防止透过的隔膜,在A极通入甲的单质,B极通入乙的单质,则A极是该电池的_______极,B极的电极反应式是 ___________