Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。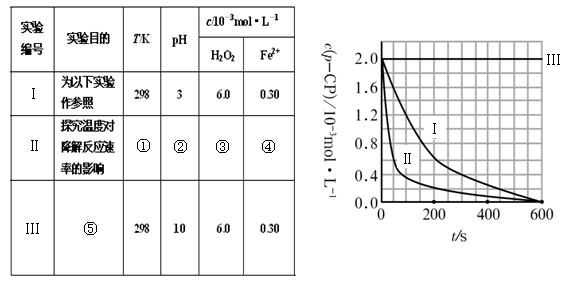
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
浓H2SO4与炭反应,产物成分可用下图装置来确认: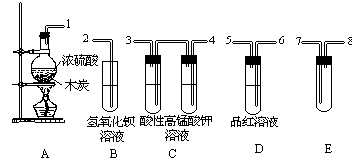
(1)A 装置中反应的化学方程式为;
(2)B 装置中反应的离子方程式;
(3)装置 C 的作用是,E中盛放的试剂是_______;
(4)请用1、2…等标号,写出装置的连接顺序:1-。
已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强。它可用于制备苯甲酸乙酯和苯甲酸铜。
(一)制备苯甲酸乙酯
相关物质的部分物理性质如表格:
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是,反应液中的环己烷在本实验中的作用。
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热。放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷。反应完成的标志是_______。
(3)步骤③碳酸钠的作用是,碳酸钠固体需搅拌下分批加入的原因。
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥。乙醚的作用。
(5)步骤⑤蒸馏操作中,下列装置最好的是________(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热)。
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品。
(6)混合溶剂中乙醇的作用是_______________,趁热过滤的原因________________
(7)本实验中下列药品不能代替氢氧化铜使用的是_____________________
A.醋酸铜B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是________
A.冷水 B.热水C.乙醇 D.乙醇水混合溶液
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为.
(2)检验沉淀B已洗净操作是.
(3)在整个实验过程中托盘天平至少使用次.
(4)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________.
方案Ⅱ.乙组同学的主要实验按如下图所示装置进行实验:

(5)该实验中装置B盛放的物质是__________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验.
(6)在C中装碱石灰来吸收净化后的气体.
①样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差____________________(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________.
(7)有的同学认为为了减少实验误差,在反应前后都要通入N2(如图),反应后通入N2的目的是_____________________.
三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3]·xH2O)是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,在工业上具有一定的应用价值。常用三氯化铁与草酸钾直接合成三草酸合铁(Ⅲ)酸钾。
为测定该晶体中铁的含量和草酸根的含量,某实验小组做了如下实验:
Ⅰ 草酸根含量的测定
步骤一:称量10.00g三草酸合铁(Ⅲ)酸钾晶体,配制成500ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.060 mol•L-1 KMnO4标准溶液滴定至终点(保留溶液待下一步分析使用),消耗KMnO4溶液20.02ml。
重复步骤二操作,滴定消耗0.060mol/L KMnO4溶液19.98ml。
Ⅱ铁含量的测定
步骤三:向步骤二所得溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤四:用0.010mol/L KMnO4溶液滴定步骤三所得溶液至终点,消耗KMnO4溶液20.01ml。
重复步骤二至四操作,滴定消耗0.010mol/L KMnO4溶液19.99ml。
请回答下列问题:
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_____、转移、洗涤并转移、_____、摇匀;
(2)滴定时,下列滴定方式中,最合理的是(夹持部分略去)(填字母序号)。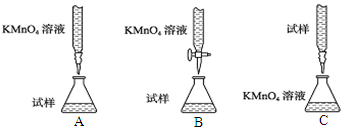
理由为_______________;滴定终点现象为:_____________;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,对实验结果会_____________(偏大、偏小、无影响);
(3)加入锌粉的目的是________________________________________;
(4)滴定中MnO4-被还原成Mn2+ ,试写出步骤二和三中发生反应的离子方程式:
_________________,__________________。
(5)实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4溶液量不够,则测得的铁含量__________。(选填“偏低”、“偏高”或“不变”)
(14分)四氯化锡用作媒染剂和有机合成上的氯化催化剂,实验室制备四氯化锡的反应、装置示意图和有关信息数据如下:
有关信息数据:①将金属锡熔融,通入干燥氯气进行反应。生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃。⑧无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾。有强烈的刺激性。回答下列问题:
(1)仪器C的名称是,仪器D的作用是。
(2)制备无水四氯化锡各装置的连接顺序是( )一( )一( )一( )一( )(填装置序号)。
(3)试剂E和F分别是、,装置V的作用是。
(4)若无装置V存在,在装置Ⅲ中除生成SnCl4外,还存在的副产物的化学式为。
(5)实验制得的SnCl4中因溶解了C12而略显黄色,提纯SnCl4的方法是。
(6)若Ⅱ中用去锡粉5.95 g.反应后,Ⅲ中锥形瓶里收集到12.0 g SnCl4,则SnCl4的产率为(结果保留三位有效数字)。