氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据上面的能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是 。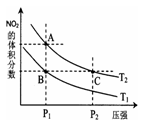
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= ,以NH3表示该过程的反应速率v(NH3)= 。
氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
(1)净化N2和H2时,铜屑的作用是:_________________;硅胶的作用是 。
(2)在氮化炉中3Si(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 。
(2)生活污水中含大量细小的悬浮物,可加某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。
(3)用CH4催化还原NOX可以消除氮氧化物的污染。例如
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2= 。
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
(1)若A为氯碱工业的产品,C为厨房中的用品。
①D的电子式是
②反应Ⅲ的离子方程式是 。
③氯碱工业制备A的反应,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是 。
② B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是______________。
铁及其化合物与生产、生活关系密切。
(1)写出铁红(Fe2O3)的一种用途: 。
(2)写出利用FeCl3溶液制备氢氧化铁胶体的离子方程式: ;
(3)已知t℃时,FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
分X、W、Y、Z均为短周期主族元素,原子序数依次增大,Y原子的最外层电子数是X的2倍,X、W、Y在周期表中的相对位置如右图所示。
| X |
|||
| W |
Y |
回答下列问题:
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y、Z两种元素的非金属性强弱 ( 用化学方程式表示 ): 。
(3)W的最高价氧化物与强碱溶液反应的离子方程式为 。
(4)X的最高价氧化物对应水化物( H3XO3 ) 是一元弱酸,在横线上填写合适的结构简式:X (OH)3 + H2O  H+ +
H+ +
(5)已知25℃:
| Y的氢化物 |
一元酸HA |
| Ka1=9.1×10-8,Ka2=1.1×10-12 |
Ka=1.1×10-10 |
写出Y的氢化物与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式: 。
(6)在烧碱溶液中,以W单质和NiO( OH ) ( 氢氧化氧镍 ) 为两极组成一种新型电池,放电时NiO( OH )转化为Ni(OH)2,写出其正极的电极反应式: 。