A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物。单质X、Y是生活中常见的金属,相关物质间的转化关系如下图所示(部分反应物与产物已略去):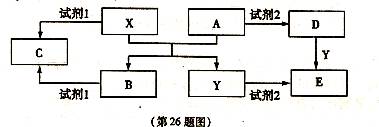
(1)若试剂l与试剂2不属于同类物质,则X与试剂l反应的离子方程式是 。
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是 。
①检验物质D的溶液中金属离子的实验操作是 。
②将物质C溶于水,其溶液呈 (填“酸性”、“中性”或“碱性”),原因用离子方程式可表示为 。
(3)若E溶液隔绝空气加热蒸干后可得到该溶液的溶质,工业上以E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有N0生成,该反应的化学方程式是 。
(Ⅰ)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:① ②
② ③
③ ④
④ ⑤
⑤ (已知酸性
(已知酸性 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)>>。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式。
(Ⅰ)某元素的原子序数为33,写出该元素原子的核外电子排布式 ,此元素的原子中被电子占据的轨道有个,有 个能级(能量不同的轨道);
(Ⅱ)有五种元素A、B、C、D、E,A2+的电子层结构为1S22S22P63S23P63d5,B原子的M层为最外层且有两个未成对电子,C原子的L电子层的P轨道上有一个空轨道,D原子的L电子层的P轨道上只有一对成对电子,E原子的M电子层的P轨道半充满。写出A---E各元素的符号:A 、B、C、D、E
按要求填空:
(1)写出下列物质的化学式:含6个碳原子的链状单烯烃 ,相对分子质量为72的烷烃
(2)在戊烷的各种同分异构体中,一氯代物只有一种的结构简式是
(3)用系统命名法命名烃: 。
。
(4)2-甲基-1,3-丁二烯与等物质的量的Br2反应,生成的产物有___________种,
该反应的类型为 反应。
(5)写出由丙烯制备聚丙烯的反应化学方程式 。 该反应的类型为_______________。
(6) 某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个—CH3、两个
 |
—CH2—、一个和一个—Cl。它的可能的结构有 种,写出其中一种
的结构简式 。
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于烃,结构简式为,该取代反应的化学方程式为______________。
若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于烃,结构简式为,该加成反应的化学方程式为。
(1)科学家通过X射线推测胆矾结构示意图可简单表示如下,图中虚线表示的作用力分别为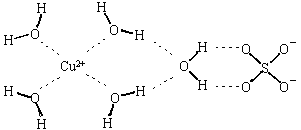
(2)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:;
(3)SiCl4与SO42一互为等电子体,预测SO42一的空间构型为