( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固) Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH― H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固) Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH― NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(2)请你说明丙同学作出该选择的理由 。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: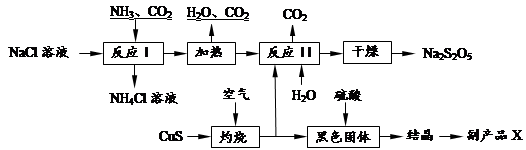
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:。
(2)反应I的化学方程式为:。
(3)“灼烧”时发生反应的化学方程式:。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:。
(5)副产品X的化学式是。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为。检验产品中含有碳酸钠杂质所需试剂是(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水
④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸
向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1)写出可能发生的有关反应的化学方程式。。
(2)在图中,纵坐标表示生成沉淀的物质的量,横坐标表示加入Ba(OH)2的物质的量。试在图中画出当溶液中明矾为1 mol时,生成的每一种沉淀的物质的量随Ba(OH)2物质的量变化的曲线(在曲线上标明沉淀的化学式)。
(3)向a L物质的量浓度为M mol/L的明矾溶液中滴加物质的量浓度为n mol/L的Ba(OH)2溶液b L,用含a、M、n的表达式表示:
①当b满足________条件时,沉淀的总物质的量为最大值;
②当b满足________条件时,沉淀的质量为最大值。
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
A的单质是密度最小的物质 |
| B |
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C |
C的原子最外层电子数是其内层电子数的三倍 |
| D |
D与B同周期,该周期中D的简单离子半径最小 |
| E |
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F |
F元素最高正价与最低负价的代数和为4 |
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示)。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为。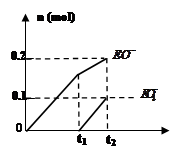
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2↑(未配平)
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是。
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是。
(2)实验I中生成沉淀的离子方程式为。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定
不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由。