NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤____________________________________________________。
⑥_____________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10?39)。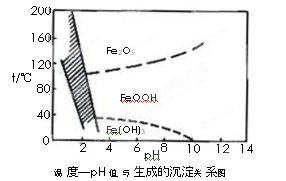
下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1) 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与 形成的化合物E的沸点 。
形成的化合物E的沸点 。
(2)配平用钙线脱氧脱磷的化学方程式:
P+ FeO+ CaO Ca3(PO4)2+ Fe
Ca3(PO4)2+ Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224mlH2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g。
完成下列各题:
(1)在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2.则原合金中有__________mol Fe,稀硫酸的物质的量浓度为__________ mol/L.
(2)已知19.2gCu与过量的200ml 5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的个数为__________(用NA表示阿伏加德罗常数);标准状况下,产生NO气体的体积为__________.
②反应后,H+的物质的量浓度为__________,NO3﹣的物质的量浓度为__________.
实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量__________g;
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒.配制时,必须使用的玻璃仪器__________(填序号),还缺少的仪器是__________;
(3)使用容量瓶前必须进行的一步操作是__________;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为__________(填序号);①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移.
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号);
①未洗涤烧杯、玻璃棒;②称量NaOH的时间太长;③定容时俯视刻度;④容量瓶不干燥,含有少量蒸馏水;⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是__________mol/L.
利用“化学计量在实验中的应用”相关知识填空.
(1)含有6.02×1023个氢原子的H2SO4的物质的量是__________;
(2)在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物,则该化合物的化学式是__________;
(3)三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl﹣、SO42﹣,则n(SO42﹣)为__________.
在下列物质中:①Na ②Fe(OH)2固体③Na2O固体 ④CO2 ⑤FeCl3溶液 ⑥蔗糖溶液 ⑦熔融MgSO4⑧NaCl晶体(请用序号填空).
属于碱性氧化物的是__________,属于盐的是__________,
属于电解质的是__________,能导电的是__________.