实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量__________g;
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒.配制时,必须使用的玻璃仪器__________(填序号),还缺少的仪器是__________;
(3)使用容量瓶前必须进行的一步操作是__________;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为__________(填序号);①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移.
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号);
①未洗涤烧杯、玻璃棒;②称量NaOH的时间太长;③定容时俯视刻度;④容量瓶不干燥,含有少量蒸馏水;⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是__________mol/L.
已知某溶液中只存在OH-、H+、NH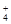 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH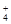 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(NH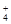 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH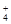 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH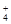 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_____________;若上述关系中④是正确的,则溶液中的溶质为____ ___。
(3)上述关系②是否正确:____________(填正确或不正确),_________________(正确则指明溶质,不正确 则说明原因)
则说明原因)
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)_______c(OH-)。
(5)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号)________________;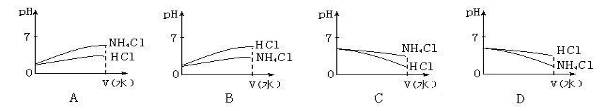
有均为1 mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)
mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)
Ⅰ.25℃时,①氢氟酸 ②醋酸 ③次氯酸的电离常数分别是3.5×10-4、
1.8×10-5、3.0×10-8。请推测:
(1)它们的酸性由强到弱的顺序为______________________(填序号,下同),
(2)相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;
(3)相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:___________
A、B、C为三种常见的单质,其中A、C为气体,B为常见金属。A溶于水所得的溶液可使石蕊试液先变红后退色。F的水溶液为浅绿色溶液,它们的关系如图:
(1)写出A、B、D的化学式:A.B.D.
(2) 写出反应①②的离子方程式
①
②
(3)检验D的水溶液中的阳离子的方法是:。将D溶液逐滴加入沸水中会产生一种红褐色的澄清液体。有同学认为该液体中的分散质粒子直径应该在1nm~100nm之间,验证这一想法的简单方法是:。
(4)如右图某同学将A的饱和溶液装满大试管倒置于烧杯中,光照一段时间后,发现试管底部有无色的气体产生,溶液 的颜色也变成无色,请你帮他对产生的气体进行探究:
的颜色也变成无色,请你帮他对产生的气体进行探究:
a.你预测气体可能是。
b.针对你的预测写出验证实验方案:。
Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓)  MnCl2+
MnCl2+  Cl2↑+ 2H2O,
Cl2↑+ 2H2O,
(1)用双线桥标出电子转移方向和数目。(在答题卷上标)
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为,被氧化HCl的质量为。
Ⅱ、科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物。通过以上信息填空:
(1)维生素C具有(填氧化性或还原性)。
(2)上述过程中+5价砷类物质作为(填氧化剂或还原剂),+5价砷元素发生反应(填氧化或还原);2mol +5价砷完全转化为 +3价砷,共转移个电子(用NA表示阿伏加德罗常数)。