氢能源是一种重要的清洁能源。现有两种可产生的化合物甲和乙。将6.00甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 (已折算成标准状况)。甲与水反应也能产生,同时还产生一种白色沉淀物,该白色沉淀可溶于溶液。化合物乙在催化剂存在下可分解得到和另一种单质气体丙,丙在标准状态下的密度为1.25。请回答下列问题:
(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与反应可生成和气体丙,写出该反应的化学方程式。
有人提出产物中可能还含有,请设计实验方案验证之。
(已知)
(5)甲与乙之间(填"可能"或"不可能)发生反应产生,判断理由是。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___ _____ mL。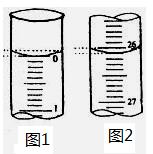
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)=。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
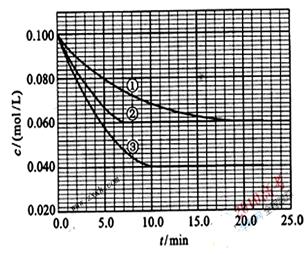
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
 ②_______________;
②_______________;
③;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的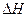 _________0,判断其理由是______ ________;
_________0,判断其理由是______ ________;
(4)该反应进行到4.0min时的平均反应速度率(读数均保留两位有效数字):
实验②: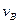 =__________________________________;
=__________________________________;
实验③: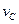 =__________________________________。
=__________________________________。
红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题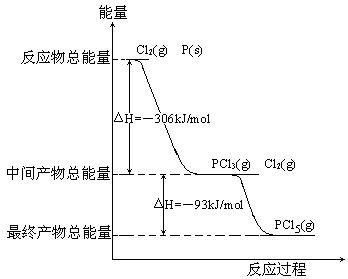
(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3=;
P和Cl 2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少量样品中,振荡;②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫的价态为+6价。
(1)上述实验中产生的沉淀是。
(2)你认为甲的判断是否正确(填“是”或“否”),作出这种判断的依据是。
(3)请完成对硫元素价态的探究:
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L-1H2SO4、2mol·L-1 HCl、2mol·L-1HNO3、3%H2O2、0.5mol·L-1BaCl2、品红试纸、蒸馏水。
①提出合理假设
假设1,硫的价态是+4价
假设2,硫的价态是+6价
假设3,
②设计实验方案证明你的假设
③实验过程
根据②的实验方案,进行实验。请写出实验步骤、预期现象与结论。
| 实验操作 |
预期的现象与结论 |
| 操作1 |
|
| 操作2 |
在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质是行测定,测得如下数据:
| 物质 |
X |
Y |
Z |
Q |
| 反应前质量/g |
40.0 |
4.6 |
37.8 |
0.0 |
| 反应后质量/g |
43.6 |
待测数据 |
12.6 |
3.2 |
请回答下列问题:
(1)上表中“等测数据”的数值是,此密闭容器中化学反应类型属于反应(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比n(X):n(Y):n(Z):n(Q)=2:4:4:1,写出化学反应的方程式:。
(3)反应结束后,若将反应体系内的Y物质取出,要标准状况下测得其体积小于11.2L,其原因是。