某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___ _____ mL。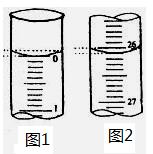
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)= 。
(12分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C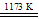 TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg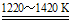 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为_____________________。
(2)与CO互为等电子体的分子是___________。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______化合物(填“离子”或“共价”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_____________________________________。
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是____________ (填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
(12分)回答下列问题
(1)CH4、CO2、COCl2和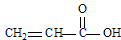 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成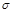 键有_______mol和形成
键有_______mol和形成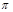 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
(16分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。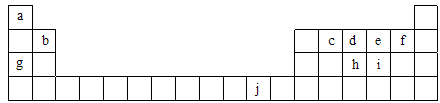
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式___________________________。
(2)在c6a6分子中,元素c为杂化,该分子是分子(填“极性”或“非极性”)。
(3)ci2分子的电子式为_________________________,ci2与ce2比较,沸点较高的是_____________(写分子式)。
(4)第一电离能:h______i;电负性:g______b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是。
| A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素 |
| B.d的基态原子中,2p能级为半充满,属于p区元素 |
| C.最外层电子排布式为4s1,一定属于ⅠA族 |
| D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族 |
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是____________________,写出蓝色沉淀溶解在氨水中的离子方程式______________________________________________________________________。
(7)j的金属晶体的晶胞如图所示,则一个晶胞中j原子的个数是_______个。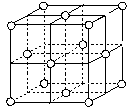
(12分)几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
| 原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于周期族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)
(3)J单质在B单质中燃烧可生成化合物X,X的电子式是,其中所含的化学键类型为。
(4)I单质可在D的最高价氧化物中燃烧,涉及的化学方程式为:。
(5)B与H所形成的化合物与J的最高价氧化物对应水化物Y的溶液发生反应的离子方程式为。
(12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)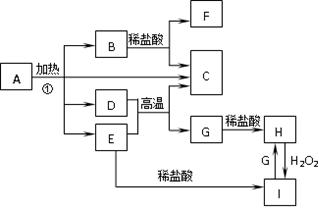
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为:;A的化学式为:。
(2)D+E→C+G的化学方程式:。
(3)H+H2O2+HCl→I的离子方程式:。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
_________________________________________________________________________。