【化学-选修2:化学与技术】
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的。由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_ 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),则沉淀物A的主要成份为 ,沉淀物B的主要成份为 。
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀的PH值 |
1.5 |
3.3 |
9.4 |
(3)若要从沉淀物A中提取出某种可用于工业冶炼铝的原料,应先向A中加入 溶液(填物质化学式)再过滤,然后向滤液中通入过量CO2,过滤、灼烧。请写出通入CO2时发生反应的离子方程式 。
(4)为确定产品aMgCO3・bMg(OH)2・cH2O中a、b、c的值,称取18.2g样品完全分解后,测得产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中a=______、b=_______、c=______。
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):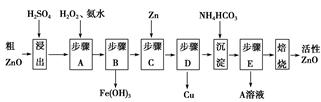
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是,该步骤需控制溶液pH的范围是。
(2)A溶液中主要含有的溶质是。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS(选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显性,用离子方程式表示原因,其溶液中离子浓度大小顺序为。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是(填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是(填字母序号)。
| A.向水中加入NaHSO4固体 |
| B.向水中加Na2CO3固体 |
| C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.向水中加入(NH4)2SO4固体 |
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m(填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为。
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 |
NH4+、H+、Na+ |
| 阴离子 |
OH-、CH3COO-、Cl- |

(1)根据pH的变化关系,写出物质的化学式:B,C。
(2)写出A与C反应的离子方程式:。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间?区间。
③FG区间溶液中各离子浓度大小关系是。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=。
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol/L,B溶液中水电离出的氢离子浓度为mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为。
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母)。
| A.向水中加入NaHSO4 |
| B.向水中加入Cu(NO3)2 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入(NH4)2SO4 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显色,溶液呈性(填“酸”、“碱”或“中”);若用pH计测定,则pH7(填“>”、“<”或“=”),溶液呈性(填“酸”、“碱”或“中”)。