(14分,每空2分)四种短周期元素A、B、C、D的性质或结构信息如下。
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:
请根据上述信息回答下列问题。
(1)C元素在周期表中的位置 , 请写出D2C2分子的结构式________,A元素的单质与物质甲发生反应的离子方程式_______。
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 。
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 。
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为;该溶液pH<7的原因是(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子。Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。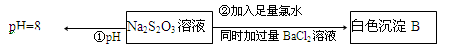
实验①可说明(填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂(填“是”或“否”),KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于(填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a=cm。(用含ρ、NA的计算式表示)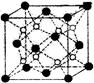
(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为,空间构型。
②基态W原子的核外电子排布式。
③Y、Z、M三种元素的第一电离能由大到小的顺序为(用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g)△H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g)△H=+180.5kJ·mol-1
则上述反应的热化学方程式是。
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为(精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3mol。
52.有反应Al2O3(s)+ Na2CO3(s)
 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| Al2O3 |
Fe2O3 |
Na2O |
|
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:
得到的赤泥t(精确到0.001,下同);
可制得Al2O3得t;
需要补充购买Na2CO3kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a=;b=(精确到0.001).
醛类是重要的有机物。
47.松柏醇臭氧化反应生成的B含有醛基。
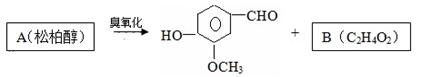
写出结构简式:B;A。
48.已知:
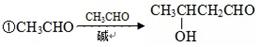
②醛甲+醛乙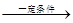 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下:
(1)写结构简式:D;季戊四醇。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因。
(3)实际生产中甲醛过量,原因是。
49.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为。
50.环己酮中α-H也比较活泼,能发生反应:
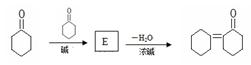 ,则E的结构简式为。
,则E的结构简式为。
煤焦油中含有多种芳香族化合物,是重要的化工原料。以下是用煤焦油制备均三溴苯的流程。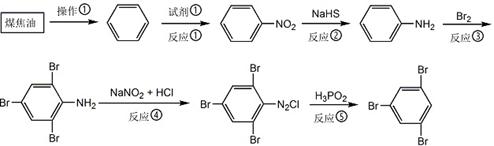
42.操作①的名称是;试剂①是;反应②中,NaHS作剂。
43.均三溴苯的系统命名为。
44.不用硝基苯直接溴化制取均三溴苯,理由是。
指出苯胺比苯更易发生取代反应的二个事实。
45.苯胺是微溶于水的液体,呈弱碱性。若苯胺中含少量的苯和硝基苯,简述提纯步骤。
46.氨基与羟基有许多相似的性质,则苯胺与醋酸酐[(CH3CO)2O]在一定条件下反应,除了生成CH3COOH外,生成的另一种有机物的结构简式为。