在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质是行测定,测得如下数据:
| 物质 |
X |
Y |
Z |
Q |
| 反应前质量/g |
40.0 |
4.6 |
37.8 |
0.0 |
| 反应后质量/g |
43.6 |
待测数据 |
12.6 |
3.2 |
请回答下列问题:
(1)上表中“等测数据”的数值是 ,此密闭容器中化学反应类型属于 反应(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比n(X):n(Y):n(Z):n(Q)=2:4:4:1,写出化学反应的方程式: 。
(3)反应结束后,若将反应体系内的Y物质取出,要标准状况下测得其体积小于11.2L,其原因是 。
某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)固体B的主要用途有(写出1条即可)。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:
;。
(3)第③步中,生成氢氧化铝的离子方程式是。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_________________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似。钙及其化合物的有关反应如下:
①Ca+2H2O=Ca(OH)2+H2↑②CaO+H2O=Ca(OH)2 ③CaO+CO2=CaCO3
④CaO2+H2O=(未配平)⑤2CaO2+2CO2=2CaCO3+O2
结合所学知识完成下列问题:
(1)写出上述④的化学方程式:;
(2)用单线桥标出反应①的电子转移方向和数目:Ca+2H2O Ca(OH)2+H2↑
Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式:;
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是。
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。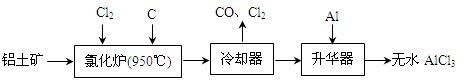
(1)氯化炉中Al2O3、C12和C反应的化学方程式为。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为,在标准状况下,吸收112L Cl2需要molNa2SO3。
(3)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AlCl3,实现这一步的操作方法是在(填试剂)中加热。
(4)工业上铝土矿经提纯后可冶炼铝,写出在950-970℃和冰晶石作用下进行电解制铝反应的化学方程式。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g)ΔH>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是。
CO(g)+H2(g)ΔH>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(计算结果保留两位有效数字)。
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨。已知:
N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ•mol-1
2NH3(g)ΔH=-92.4kJ•mol-1
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH=" +1530.0kJ" /mol
4NH3(g)+3O2(g)ΔH=" +1530.0kJ" /mol
①氢气的燃烧热ΔH=_______________。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在下图中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图,并作必要的标注。
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是。
| A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1 |
| B.容器内压强保持不变 |
| C.H2的消耗速率与CH3OH的消耗速率之比为3∶1 |
| D.容器内的密度保持不变 |
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。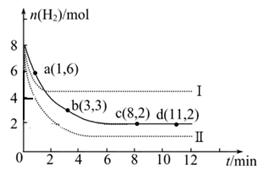
①a点正反应速率逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是,曲线II对应的实验条件改变是。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为:。