请回答下列问题:
(1)、、、四种元素中,有一种元素的电离能数据如下:
| 电离能 … |
| 578 1817 2745 11578 … |
(2)则该元素是(填写元素符号)。原子的电子排布式是。的最高价氯化物分子式是。该元素可能的性质或应用有。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物  ,下列叙述正确的有。
,下列叙述正确的有。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个键和1个键
D.该分子在水中的溶解度大于2-丁烯
(4)的熔点 的熔点(填>、<或=),其原因是
的熔点(填>、<或=),其原因是
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物(Fe3I8),若该化合物中铁元素与碘元素的质量比_______,则反应Ⅱ的化学方程式是________________________________。
②操作A包括加热浓缩、______________、______________;用冰水洗涤的目的是______________。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①配平第一步反应的化学方程式:___H2O2+___I2→____HIO3+____H2O
②烹饪时,含KIO3的食盐常在出锅前加入,其原因是_______________________。
③若制得1.284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水__________kg。
喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分
别盛有液体。下列组合中不可能形成喷泉的是()。
A.HCl和H2O B.Cl2和NaOH溶液
C.HCl和汽油 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是()
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是()
A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱
实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
| 编号 |
A |
B |
C |
发 生 装 置 |
 |
 |
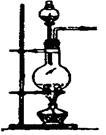 |
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是 (写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是 (写编号),写出微热时的反应方程式 ;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中 元素被氧化, 是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示: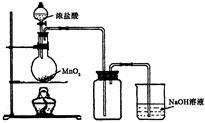
写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
在25℃、100kPa条件下,将15L O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中:V(CO)= ___________L;V(H2)= ___________L。
(2)若剩余气体的体积为a L,求原混合气体中CO和H2的体积比。
(3)若剩余气体的体积为b L,计算b的取值范围。
已知:CH4(g)+2O2(g)→CO2(g)+2H2O(l)+Q1;2H2+O2(g)→2H2O(g)+Q2;
2H2+O2(g)→2H2O(l)+Q3;若体积比为4:1的甲烷与氢气的混合气体11.2L(S.T.P)在氧气中完全燃烧,恢复至室温,放出的热量为_________________(表达式)。