如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充人lmdA、3molB,此时两容器体积均为500mL,温度为T0C保持温度不变发生反应:

(1) 下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是__ __(2分,全才得分)。
A.混合气体的总质量不随时间改变 B 2V正(C)=3V逆(B)
C. A、B转化率相等 D.物质D的质量不随时间改变
(2) 2minn后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为____(2分)mL,B的转
化率a甲(B)为____ (2分)。
(3) 乙容器中反应达到平衡所需要的时间____2min(2分)(填“>”、“<”或“=”,下同),B的转化率a乙(B)为___ a甲(B) (2分)。
(4) 其它条件不变,甲中如果从逆反应方向开始建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加人C的物质的量n(C)为____ (2分)mol,加人D的物质的量n(D)应该满足的条件为 (2分)。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是:和。
(2)试通过计算确定该结晶水合物的化学式为。
(3)①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
。
②若加人75mL的Ba(OH)2溶液,则得到的沉淀质量为g。
有下列七种溶液:
| A.氢氧化钠溶液; | B.氢氧化钡溶液; | C.硫酸铝溶液; | D.明矾溶液; |
E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;
任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 甲 |
B |
|||||||
| 乙 |
D |
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
(3)下图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲(填化学式);乙(填化学式)。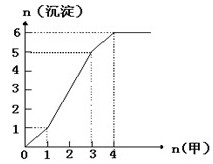
若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度
(10分)、在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1molX和3molY,此时容积为VL。保持恒温恒压,发生反应X(g)+ 3Y(g)  2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为。
(2)保持上述温度和压强恒定不变,若向容器中只充入4molZ,则反应达到平衡时,平衡气体中Y的体积分数为,容器的容积为L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2molX和6molY反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105Pa,若a : b =" 1" : 3,则a=
(10分)、有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)有机物A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算:生成CO2共为mol, 生成的H2Og。 有机物A的分子式。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(4)A的结构简式。 |
| (4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中和链端。 |
|
| (5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因 |
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):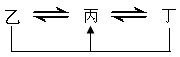
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式:。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是:。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式,析出该复盐晶体的原理是 。