水处理剂能使工业循环冷却系统保持良好状态。以下是两种新型水处理剂的合成方法。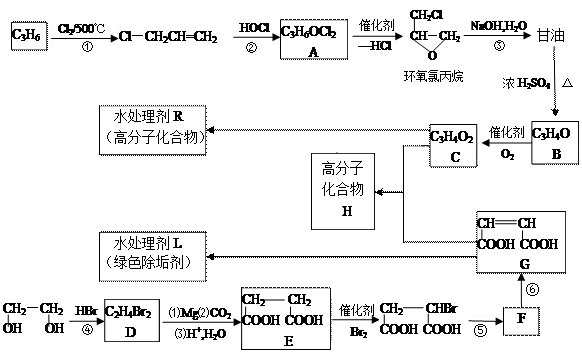
完成下列填空:
(1)写出反应类型。反应① 反应② 。
(2)反应④通常用一种盐和一种酸代替HBr参加反应,它们的名称是 和 。
(3)写出化学方程式。
B与新制氢氧化铜反应生成C ;
反应⑤ 。
(4)D转化为E的过程中,E分子中增加的碳原子来源于 ________(写物质的名称)。
(5)写出H的 结构简式 。
结构简式 。
(6)E有多种同分异构体,其中能发生银镜反应、能发生缩聚反应,还能两分子生成六元环状化合物的物质的结构简式为 。
(6分) 某溶液中含有SO42-、CO32-、OH-三种阴离子,如果只取一次溶液,分别将这三种离子检验出来,那么应:
⑴先检验,加入试剂(或溶液)
⑵再检验,加入试剂(或溶液)
⑶最后检验,加入试剂 (或溶液)
(2分) 书写下列微粒的电子式:
⑴CS2;⑵Ca(OH)2 。
目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、烟雾事件、酸雨的形成、有毒物质的污染等已成为目前世界各国人民普遍关心的问题。请回答下列问题:
(1)产生温室效应的原因主要是大气中含有
A、SO2 B、NO2 C、CO2 D、CO
(2)臭氧层的破坏导致紫外线对地球表面辐射量增加,从而使全球皮肤癌的发病人数明显增加。造成这一现象的主要原因是
A、人们大量使用氟氯代烷
B、人们在炼钢时向空气中排放了大量的高炉煤气
C、石油炼制厂排放了大量的甲烷、氢气
D、硫酸、硝酸工厂排放了大量的二氧化硫和一氧化氮
(3)在20世纪60年代,一些工业发达国家的城市都发生过烟雾事件,并造成数以千计的人死亡。造成这一现象的主要原因是
A、汽油的不完全燃烧 B、大量使用了农药化肥
C、白色塑料垃圾的漂浮 D、金属矿物的冶炼
阿司匹林的结构简式如图:
根据这一信息,回答下列问题:
(1)写出阿司匹林的分子式:
(2)根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是
| A.氢氧化钠溶液 | B.硫酸钠溶液 | C.碳酸钠溶液 | D.稀硫酸 |
已知有以下物质相互转化。试回答: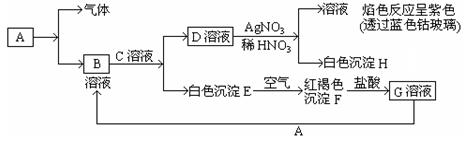
(1)写出B的化学式,D的化学式。
(2)写出由D转变成H的离子方程式。
(3)写出用KSCN鉴别G溶液的现象为;向G溶液加 入A的有关离子反应方程式。
入A的有关离子反应方程式。