在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
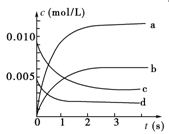
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
A、B、C、D,E和F是六种短周期元素,它们的原子序数依次增大。 A和D,C与F为同主族元素;A的单质是最轻的气体; B元素最高价氧化物的水化物与其气态氢化物反应生成盐; E元素是地壳中含量最多的金属元素。F元素原子M层上电子数比L层少2个电子。 试完成下列填空
(1)E元素位于周期表的第周期族。
(2)F简单阴离子的结构示意图 。
(3)铜与B元素最高价氧化物的水化物的稀溶液反应的离子方程式为。
(4)E的硫酸盐溶液中滴入B元素气态氢化物的水溶液,直至过量。离子方程式为。
用ZX表示原子:
(1)中性原子的中子数N=
(2)AXn+共有x个电子,则该阳离子的中子数N=
(3)AXn-共有x个电子,则该阴离子的中子数N=
(4)12C16O2分子中的中子数N=
硫酸在下列用途或反应中所表现的性质(用字母填在横线上)。
| A.难挥发性 | B.强酸性 | C.吸水性 | D.脱水性 E.强氧化性 |
① 浓硫酸可用作气体干燥剂 ;
② 往晶体硫酸铜中加浓硫酸,晶体变白;
③ 浓硫酸与铜反应;
④ 运用铁制槽车和铝制槽车运输浓硫酸;
⑤ 浓硫酸使润湿蓝色石蕊试纸先变红后又变黑。
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除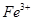 外还可能含有
外还可能含有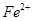 。若要确认其中的
。若要确认其中的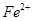 ,应选用选填序号)。
,应选用选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性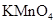 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: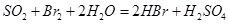 ,然后加入足量
,然后加入足量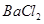 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中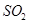 的体积分数为。
的体积分数为。
[探究二]
分析上述实验中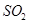 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。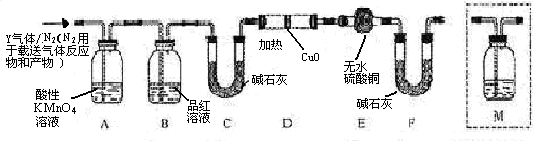
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是。
,预计实验现象应是。
已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
(1)A的名称是; F的化学式是。
(2)C+B→D反应的化学方程式为。
(3)F+D→C反应的化学方程式为。
(4)F在空气中遇水蒸气产生白雾现象这白雾实际上是。