捕碳技术(主要指捕获)在降低温室气体排放中具有重要的作用。
目前和已经被用作工业捕碳剂,它们与可发生如下可逆反应:
反应Ⅰ:2++
反应Ⅱ:++
反应Ⅲ:++ 2
2
请回答下列问题:
(1)与、之间的关系是:
(2)为研究温度对捕获效率的影响,在某温度T1下,将一定量的溶液置于密闭容器中,并充入一定量的气体(用氮气作为稀释剂),在时刻,测得容器中气体的浓度。然后分别在温度为、、、下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得气体浓度,得到趋势图(见图1)。则:
①
②在~及~二个温度区间,容器内气体浓度呈现如图1所示的变化趋势,其原因是
③反应Ⅲ在温度为时,溶液随时间变化的趋势曲线如图2所示。当时间到达时,将该反应体系温度上升到,并维持该温度。请在图中画出时刻后溶液的变化总趋势曲线。
(3)利用反应Ⅲ捕获,在初始浓度和体积确定的情况下,提高吸收量的措施有
(4)下列物质中也可能作为捕获剂的是
(1)硫化氢具有还原性,可以和许多氧化剂反应。H2S通入硫酸酸化的KMnO4溶液,反应生成S、MnSO4等,写出该反应的化学方程式:。
(2)硫铁矿氧化焙烧的化学反应如下: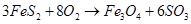
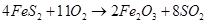
若24mol FeS2完全反应耗用氧气1467.2L(标准状况);反应产物中Fe3O4与Fe2O3物质的量之比为。
(3)在常温常压下氢气与氧气的混合气体10L,将混合气体点燃充分反应后恢复到原来状况剩余气体1L,则原混合气体中氢气和氧气的体积比为
(4)将钠—铝合金共a 克,投入足量水中生成气体最多mol,如果投入到足量的稀硫酸中生成气体体积最多mol(用含a的代数式表示,上同)
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。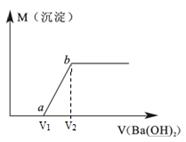
(1)该溶液中一定含。(填化学式)
(2)写出图中a点之前的离子方程式:
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C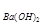 =。
=。
(1)写出下图中序号①~③仪器的名称:
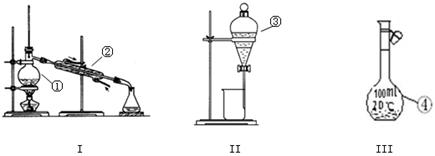
①;②;③。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现用该浓硫酸配制480 mL 1 mol· L-1的稀硫酸。
可供选用的仪器有:①胶头滴管②烧瓶③烧杯④ 玻璃棒⑤药匙⑥量筒⑦托盘天平。
请回答下列问题:
a.该硫酸的物质的量浓度为mol· L-1。
b.配制稀硫酸时,还缺少的仪器有 (写仪器名称)。
c.经计算,配制480mL 1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为__mL。
d.对所配制的稀硫酸进行测定,发现其浓度大于1 mol· L-1,配制过程中下列各项操作可能引起该误差的原因有。
| A.定容时,俯视容量瓶刻度线进行定容 。 |
| B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。 |
| C.转移溶液时,不慎有少量溶液洒到容量瓶外面。 |
| D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水 。 |
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是
(2)当反应有3.612×1024个电子转移时被硝酸钾氧化得到的氧化产物在标准状况下的体积。
(10)按要求填空
(1)金属钠与水反应的化学方程式:
(2)金属铝与氢氧化钾反应的离子方程式:
(3)硫酸氢钠与少量的氢氧化钡反应的离子方程式:
(4)Na+的原子结构示意图:
(5)标准状况下11.2L N2含有的原子数:
(6)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则A的摩尔质量是___