(11分)已知短周期元素X、W、Z、Y核电荷数依次增大。X为原子半径最小的元素,W的最外层电子数是次外层的二倍,Y的最外层电子数为电子层数的三倍。
(1)写出Z单质的电子式_______________________
(2)由X、W、Z三种元素可组成火箭燃料甲,三种元素质量比为2∶6∶7,甲蒸气密度是同温同压下氢气密度的30倍,甲分子式________。Z、Y可形成多种化合物,其中化合物乙Z2Y4可做为火箭燃料燃烧时的供氧剂。虽然化合物甲与乙都有毒,但燃烧产物却无毒。写出化合物甲与乙反应的化学方程式: ________________________
该反应生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(3)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。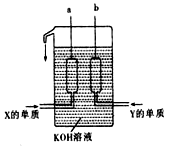
①b是电池的_____________极,a电极上的电极反应式是_________________________,消耗n molY单质时电池内转移的电子个数约为_______________。
②如果燃料电池中,a电极上改为通入X与W两种元素形成 的化合物丙(其它条件不变)写出b电极上的电极反应式是_________________________________。
③如果只把燃料电池电解质改为掺入了三氧化二釔的ZrO2晶体,它在高温下传导O2-(其它条件不变),电池工作时,固体电解质里的O2-向____________极(填a或b)移动,正极反应式为________________________。
Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
| 第一电离能 |
离子半径 |
沸点 |
| Na_______Al |
O2—_______Na+ |
CH4______H2O |
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=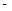 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=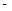 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.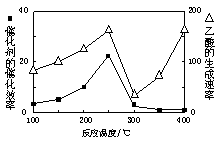
②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下: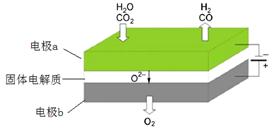
CO2在电极a放电的反应式是_______________________________
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是(用含字母a的代数式表示);
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”);
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g)的ΔH= ___________;
CH3OCH3(g) + CO2(g)的ΔH= ___________;
(2)已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正______ v逆 (填“>”、“<”或“=”);
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _______________,该时间内反应速率v(CH3OH) = __________________;
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。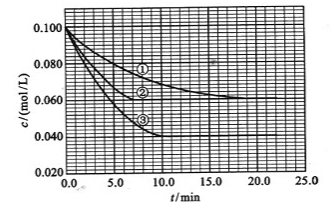
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②________________________________________________________________________;
③________________________________________________________________________;
该反应的 _________0,判断其理由是______________________________________________;
_________0,判断其理由是______________________________________________;
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示: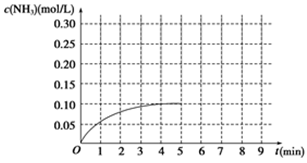
(1)根据图示,计算从反应开始到平衡时(4min末),平均反应速率v(NH3)为____________________;
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填序号);
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”);
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线。
在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
(1)420 K时,发生反应的化学方程式为__________________________,若反应中消耗1 mol Xe,则转移电子____________mol;
(2)600~800 K时,会发生反应:XeF6(g) XeF4(g)+F2(g),其反应热ΔH________0(填“>”、“=”或“<”),理由是_________________________________________________;(3)900 K时,容器中存在的所有组分__________________________________(填化学式)。
XeF4(g)+F2(g),其反应热ΔH________0(填“>”、“=”或“<”),理由是_________________________________________________;(3)900 K时,容器中存在的所有组分__________________________________(填化学式)。