Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
| 第一电离能 |
离子半径 |
沸点 |
| Na_______Al |
O2—_______Na+ |
CH4______H2O |
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=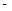 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=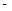 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.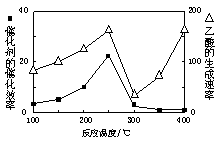
②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下: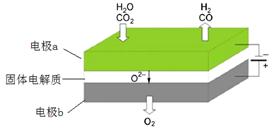
CO2在电极a放电的反应式是_______________________________
11分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极。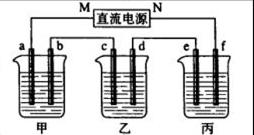
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电极b上发生的电极反应为___________________________________。
(2)电极b上生成的气体在标状况下的体积为__________________,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)_______________。
(3)电极c的质量变化是___________g,欲使电解后乙中的电解液恢复到起 始状态,应该向溶液中加入适量的___________(填字母编号)。
始状态,应该向溶液中加入适量的___________(填字母编号)。
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D. Cu2(OH)2CO3 Cu2(OH)2CO3 |
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为___________,d电极的材料为 _____________。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) ===CH4(g)+HC CH(g)+H2(g)△H1="156.6" kJ/mol
CH(g)+H2(g)△H1="156.6" kJ/mol
CH3CH CH2(g) ="==" CH4(g)+HC
CH2(g) ="==" CH4(g)+HC CH(g )△H2
CH(g )△H2 ="32.4" kJ/mol
="32.4" kJ/mol
则 相同条件下,反应C3H
相同条件下,反应C3H 8(g) ===CH3CH
8(g) ===CH3CH CH2(g)+H2(g)的△H=kJ/mol。
CH2(g)+H2(g)的△H=kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池总反应方程式为;放电时CO32-移向电池的(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=。(已知10-5.6
HCO3-+H+的平衡常数K1=。(已知10-5.6 0=2.5×10-6)
0=2.5×10-6)
(4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是
NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(用离子方程式和必要的文字说明)。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知: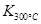 >
> ,则该反应是热反应。
,则该反应是热反应。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡 状态的是
状态的是 。
。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式: 。
。
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2 S
S O4(稀)=CuSO4+H2↑。请你在右边方
O4(稀)=CuSO4+H2↑。请你在右边方 框内画出能够实现这一反应的装置图。
框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,
看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析
其原因:。
(2分)某造纸厂排出的废水,经取样分析其中 除了含有游离汞、纤维素以及其它的有机物外,其它成分为c (Na+)
除了含有游离汞、纤维素以及其它的有机物外,其它成分为c (Na+) = 4×10—4 mol/L,c (SO42—) = 2.5×10—4 mol/L,c (Cl—) =
= 4×10—4 mol/L,c (SO42—) = 2.5×10—4 mol/L,c (Cl—) =
1.6×10—5 mol/L,c (NO3—) = 1.4×10—5 mol/L,c (Ca2+) = 1.5×10—5 mol/L,则该废水的pH为__________。