(14分)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是_______________,写出基态Fe原子的核外电子排布式_________________。
⑵血红素中N原子的杂化方式分别为________、________,在下图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为_________,δ、α两种晶胞中铁原子的配位数之比为____________。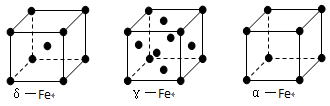
比较下列溶液的pH (填“>”、“<”、“=”)
(1)0.1mol/LNH4Cl溶液______0.01mo1/L NH4Cl溶液;
(2)0.1mol/LNa2CO3溶液______0.1mol/L NaHCO3溶液;
(3)25℃、1mol/LFeCl3溶液_____80℃、1mol/LFeCl3溶液;
(4)0.1mol/L(NH4)2CO3溶液______0.1mol/L Na2CO3溶液。
0.1mol/L的NaHSO3。溶液中,c(Na+)+c(H+)==_______________,
c(HSO3-)+c(SO32-)+c(H2SO3)==_______________。
现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
化学推断常用到离子共存知识和有关新知识的预测 :现有A、B两瓶混合溶液,两瓶溶液中所含8种离子是:Na+、K+、Al3+、H+、NO3-、Cl-、OH-、CO32-,已知每组溶液中均含两种阳离子和两种阴离子。
(1)A组:H+、。
(2)将两组溶液混合,其中两种离子与水共同反应,同时得到白色沉淀和无色气体,该反应的离子方程式是。
对于下列氧化还原反应,请按要求填空。
(1)Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑ + 2H2O
①氧化剂____________②离子方程式____________________________
(2)2H2S + SO2 === 3S↓ + 2H2O
①用双线桥法标出电子转移的方向和数目____________________________
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为________________