影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。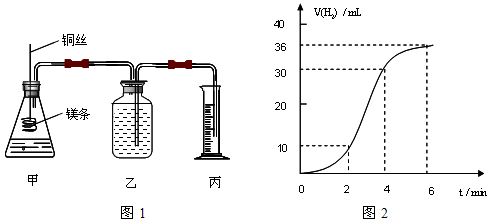
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率(mL/min)与时间(min)的关系曲线。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:_______________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中___________________,实验b中__________________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(1)用天平称取________g NaOH配制500 mL 2.0 mol·L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是 。
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2-二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
下图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略。
(1)实验室制取乙炔时,分液漏斗中的液体a通常是__________________________;
(2)圆底烧瓶中生成乙炔的化学方程式是__________________________;
(3)硫酸铜溶液的作用是____________________________;
(4)将通过硫酸铜溶液的气体通入溴的四氯化碳溶液中,反应的方程式是_______________;
若改为通入酸性高锰酸钾溶液中,现象是__________________________________;
(5)乙炔与氯化氢加成可以生成氯乙烯聚合生成聚氯乙烯的方程式是__________________。
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为___________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
| 编号 |
a |
b |
c |
d |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
装置B是安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象___________。
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是___________________________。
该现象________(填“能”或“不能”)说明Br2的氧化性强于I2。
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式_________________;你认为___________(填“能”或“不能”)改用NaHSO3溶液。
氮及其化合物在生产、生活中有着非常重要的作用。题中相关的实验装置如下:

(1)实验室制取较为干燥的氨气的反应方程式为 ;可选择上图中的装置a、b、c中的 (填代号)来制取。
(2)实验室通过使用氮气和氢气模拟工业合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热反应制取氮气。
①写出上述制取氮气的反应的化学方程式: ;
②从上图a、b、c中选择制取气体的合适装置(填代号):N2_______、H2________。
③氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,___________(“会”或“不会”)发生倒吸。
④用乙装置吸收一段时间氨后,再通入空气,同时将热的铂丝插入乙装置的锥形瓶内,写出装置中氨的催化氧化的化学方程式:_____________。
⑤乙装置的锥形瓶内铂丝保持红热的原因是________________。
⑥反应结束后锥形瓶内溶液中的含氮离子有_____________(填离子符号) 。
(3)农村有句谚语——雷雨肥庄稼,即雷雨时自然界发生了一系列的反应,合成了植物生长需要的氮肥,有利于植物生长。这其中使游离态的氮直接转化为化合态的氮的化学反应方程式为 。
(4)目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,该化学反应方程式为 。
(5)一定条件下, N2O和CO的混合气体在点燃条件下恰好完全反应,生成的三种产物均为大气组成气体,并测得反应后气体的密度为反应前气体密度的 倍。请写出该反应的化学方程式 。
倍。请写出该反应的化学方程式 。